Anorganski spojevi ugljika
- navesti alotropske modifikacije ugljika
- opisati strukturne osobitosti alotropskih modifikacija ugljika
- povezati strukturne osobitosti alotropskih modifikacija ugljika s njihovim fizikalnim i kemijskim svojstvima
- imenovati i opisati fizikalna i kemijska svojstva najvažnijih anorganskih spojeva ugljika
- odabrati testni reagens za dokazivanje ugljikova(IV) oksida
- napisati jednadžbe kemijskih reakcija gorenja ugljika uz dovoljnu i nedovoljnu količinu kisika
- obrazložiti smrtnu opasnost od udisanja ugljikova(II) oksida
- obrazložiti smrtnu opasnost od izloženosti ugljikovu(IV) oksidu.
Uvod
Ugljik – kemijski element života, vrlo je reaktivan kemijski element te stvara mnogo kemijskih spojeva. Nalazi se u sastavu živih bića, u tlu, vodi i zraku. Najveća količina ugljika na Zemlji nalazi se u karbonatnim mineralima poput vapnenca i dolomita, no velika je količina ugljika također u sastavu nafte, ugljena i zemnog plina.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Tvarima u lijevom stupcu pridruži jedan pojam iz desnog stupca.
tlo
bjelančevine
voda
ugljikov(IV) oksid
zrak
magnezijev karbonat
živo biće
kalcijev hidrogenkarbonat
Želite li pokušati ponovo?
Ugljik može biti pravilne ili nepravilne kristalne strukture (građe).
Amorfni ugljik – ugljik bez pravilne kristalne strukture, primjerice čađa, prirodni ugljen, aktivni ugljen i koks.
Ugljik pravilne kristalne građe nalazimo u dijamantu, grafitu i fulerenu.
Ugljik koji se ne nalazi u pravilnoj kristalnoj strukturi nazivamo amorfnim ugljikom. Takvi su na primjer čađa, prirodni ugljen, aktivni ugljen i koks. U pravilnoj kristalnoj građi ugljik se može naći u trima alotropskim modifikacijama: kao dijamant, grafit i fuleren.
Alotropske modifikacije ugljika
Dijamant
Dijamant je bezbojan i proziran kristal, najtvrđi je mineral u prirodi.
Ako sadrži primjese drugih tvari, može biti žute ili smeđe boje.
Ne provodi električnu energiju, ali je dobar vodič topline.
Dijamant lomi svjetlost, stoga njegovi brušeni kristali imaju lijep sjaj i koriste se za izradu skupocjenog nakita.
Zbog svoje tvrdoće koristi se za proizvodnju alata za bušenje, rezanje i brušenje.
Dijamant je bezbojan i proziran kristal, najtvrđi je mineral u prirodi. Ima gustoću 3,51 g/cm3 i visoko talište (3547 °C).
Ugljik u ovoj alotropskoj modifikaciji ne provodi električnu energiju, ali je dobar vodič topline.
Dijamant lomi svjetlost, stoga njegovi brušeni prirodni kristali imaju lijep sjaj i koriste se za izradu skupocjenog nakita.
Ako dijamant sadrži primjese nekih drugih tvari, može imati i druge boje, poput žute ili smeđe. Zbog svoje tvrdoće umjetno proizvedeni dijamanti koriste se za proizvodnju alata za bušenje, rezanje i brušenje.
Svojstva dijamanta proizlaze iz njegove građe. Struktura dijamanta pripada kubičnom kristalnom sustavu u kojem je svaki atom ugljika povezan s četirima drugim atomima ugljika jakim i stabilnim vezama. Veze između atoma ugljika imaju tetraedarski raspored.
Masa dijamanata iskazuje se posebnom jedinicom, karat, pri čemu je .
Izračunajte koliko iznosi masa u gramima dijamanta Afričke zvijezde koji ima 530 karata.
Rješenje: .
Grafit
Od grafita se izrađuju obične grafitne olovke.
Promotrite fotografiju, a zatim minu obične olovke i upoznajte svojstva grafita:
- grafit je čvrsta tvar sivo-crne boje
- površina grafita ima blagi metalni sjaj
- mekan je (pokušajte prelomiti minu)
- mastan je kad ga opipamo.
Grafit je dobar vodič topline i električne energije.
Grafit podnosi vrlo visoke temperature pa se koristi i za izradu posuda za taljenje metala te elektroda.
Pojedine slojeve grafita nazivamo grafeni.
Veze između pojedinih slojeva grafena su slabe, što omogućava pisanje grafitnom olovkom.
Grafit je čvrsta tvar sivo-crne boje, mekan je i mastan na opip. Površina grafita ima blag metalni sjaj. Manje je gust od dijamanta (2,26 g/cm3), ali je dobar vodič topline i električne energije. Grafit ima visoku vatrostalnost, ne tali se, već pri 3670 °C sublimira.
Grafit se koristi kao elektrodni materijal i za izradu posuda za taljenje metala. Od grafita se radi grafitno mazivo otporno na visoke temperature, npr. kod kugličnih ležajeva, a izrađuju se i obične grafitne olovke.
Struktura grafita je slojevita. Svaki se sloj sastoji od ravne mreže šesteročlanih prstenova u kojima je svaki ugljikov atom povezan s trima susjednim atomima. Veze među atomima su jake, a između slojeva slabije.
Pojedine slojeve grafita nazivamo grafeni. Veze između pojedinih slojeva grafena slabe su i omogućuju lako odvajanje i klizanje slojeva. Zbog toga grafitna olovka ostavlja trag na papiru.
Fuleren
Fuleren ili bijeli ugljik alotropska je modifikacija ugljika kuglasta ili cjevasta oblika.
Ta modifikacija ugljika otkrivena je 1987. godine u svemiru, a od tada se pripravlja i u laboratorijima.
Najčešća molekula fulerena oblika je šuplje kugle.
Fuleren
Fuleren ili bijeli ugljik alotropska je modifikacija ugljika kuglasta ili cjevasta oblika. Ta modifikacija ugljika otkrivena je 1987. godine u svemiru, a od tada se pripravlja i u laboratorijima.
Najčešća molekula fulerena oblika je šuplje kugle koja se sastoji od 60 ugljikovih atoma povezanih međusobno u 12 peterokuta i 20 šesterokuta. Osim toga, kuglasti fulereni mogu imati i 20, 26, 70 ili 100 atoma ugljika.
Taj novi materijal podložan je intenzivnim istraživanjima i očekuje se njegova primjena kao supravodiča, katalizatora i prijenosnika ljekovitih tvari, a najviše u elektronici i nanotehnologiji.
Na temelju videozapisa Struktura dijamanta, grafita, grafena i fulerena usporedite strukture alotropskih modifikacija ugljika.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Tvarima u lijevom stupcu pridružite točan opis iz desnog stupca.
grafit
čvrsta tvar, blagi metalni sjaj, vodič topline i električne energije
dijamant
otkriven u svemiru, kuglasta ili cjevasta oblika
fuleren
dobar vodič topline, proziran, bezbojan, najtvrđi mineral
Želite li pokušati ponovo?
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Tvarima u lijevom stupcu pridružite jedan pojam iz desnog stupca.
grafit
slojevita struktura, slojevi sadrže šesteročlane prstenove
dijamant
kuglasta šuplja molekula, pravilan poliedar,
fuleren
kubična struktura, tetraedarski raspored veza među atomima
Želite li pokušati ponovo?
Grafit i dijamant – koja je od tih dviju alotropskih modifikacija ugljika vodič električne energije? Pogledajte videozapis koji slijedi i pronađite odgovor.

Grafen – materijal budućnosti
Grafen je ultratanak materijal, dvjesto puta jači od željeza, ima 20 %-tnu rastezljivost, provodi električnu energiju i toplinu, proziran je, nepropustan, kemijski inertan.
Nobelova nagrada za fiziku 2010. godine dodijeljena je za otkriće grafena. Otad je osmišljeno više od osam tisuća patenata povezanih s grafenom.
U suradnji s drugim učenicima istražite zašto se grafen smatra revolucionarnim materijalom u industriji.
Anorganski spojevi ugljika
Najvažniji spojevi ugljika koji nisu u sastavu živih bića jesu ugljikovi oksidi, ugljična kiselina i njezine soli: karbonati i hidrogenkarbonati.
Ugljikovi oksidi
Ugljik stvara dvije vrste oksida u kojima ima valencije (II) i (IV). To su plinovi vrlo sličnih svojstava, ali se i značajno razlikuju.
O oksidima ugljika govorilo se i u prvom modulu. Provjerite svoje znanje rješavajući sljedeći zadatak. U radu vam može pomoći prijatelj iz razreda.
Ugljikov(II) oksid, CO
Ugljikov(II) oksid ili ugljikov monoksid u prirodi se pojavljuje kao sastojak vulkanskih plinova.
Nastaje nepotpunom oksidacijom ugljika iz fosilnih goriva.
ugljik + kisik → ugljikov(II) oksid ili ugljikov monoksid
Ugljikov(II) oksid,
Ugljikov(II) oksid ili ugljikov monoksid u prirodi se pojavljuje kao sastojak vulkanskih plinova. Najčešće nastaje nepotpunom oksidacijom ugljika iz fosilnih goriva.
U laboratoriju se ugljikov(II) oksid može proizvesti reakcijom dehidratacije metanske kiseline ili njezinih soli. Kao dehidratacijsko sredstvo koristi se sumporna kiselina.
Ugljikov(II) oksid plin je bez boje i mirisa, nešto je lakši od zraka, vrelište mu je pri -191 °C i slabo je topljiv u vodi. Zapaljiv je i gori plavim plamenom.
Ugljikov(II) oksid važna je industrijska sirovina. Koristi se pri proizvodnji željeza jer pospješuje difuziju ugljika u željezo. U smjesi s drugim plinovima ugljikov(II) oksid služi kao industrijsko gorivo.
Koristeći se drugim izvorima znanja, istražite kako se proizvodi i za što se koristi vodeni plin. Istraživački zadatak obavite uz suradnju svojih prijatelja iz razreda.
Zašto je ugljikov(II) oksid opasan?
Ugljikov(II) oksid otrovan je plin. Ubraja se u krvne otrove jer se veže na hemoglobin u crvenim krvnim stanicama na mjesto gdje bi se trebao vezati kisik. Time je onemogućena normalna opskrba stanica kisikom. Znakovi su trovanja: glavobolja, vrtoglavica, lupanje srca, opća slabost, šum u ušima, nesvjestica i grčenje. Prva pomoć pruža se iznošenjem otrovane osobe na svježi zrak, davanjem umjetnog disanja i udisanjem kisika.
Većina kućanstava koristi peći na drva ili fosilna goriva. Opasnost od ugljikova(II) oksida prijeti nam također iz plinskih pećnica, automobila u garažama i nepročišćenih dimnjaka.
Ugljikov(II) oksid nevidljivi je ubojica jer ga ne možemo vidjeti, nanjušiti ili na bilo koji drugi način osjetiti.
| količina ugljikova(II) oksida u zraku | vrijeme izloženosti | simptomi |
|---|---|---|
| 200 ppm | 50 min | glavobolja i oslabljene mentalne funkcije |
| 500 ppm | 20 min | glavobolja, šum u ušima, zbunjenost |
| 1000 ppm | 10 min | glavobolja, mučnina, vrtoglavica, slab vid, pospanost, lupanje srca, nesvjestica |
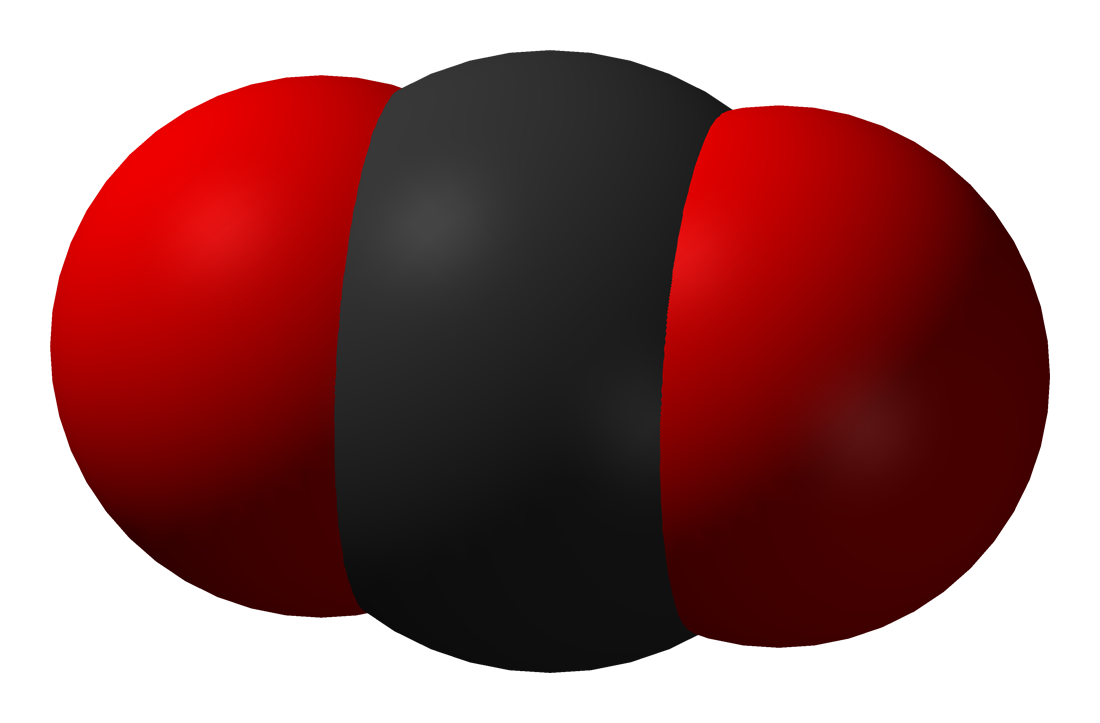
Ugljikov(IV)oksid, CO2
Ugljikov(IV)oksid ili ugljikov dioksid sastavni je dio atmosfere.
Stvara se u procesu staničnog disanja životinja i ljudi, troši se u procesu fotosinteze.
ugljik + kisik → ugljikov(IV) oksid ili ugljikov dioksid
Ugljikov(IV) oksid,
Ugljikov(IV) oksid ili ugljikov dioksid u prirodi je sastavni dio atmosfere, volumnog udjela 0,035 %. Stvara se u procesu staničnog disanja životinja i ljudi, troši se u procesu fotosinteze. Nastaje potpunom oksidacijom ugljika i njegovih organskih spojeva.
Ugljikov(IV) oksid plin je bez boje i mirisa, ne gori i ne podržava gorenje. Topljiv je u vodi i gušći od zraka. Zato se zadržava pri dnu zatvorenih prostora (bunari, špilje, jame, vinski podrumi).
Ugljikov(IV) oksid upotrebljava se u aparatima za gašenje požara, za pakiranje namirnica bez konzervansa, za proizvodnju bezalkoholnih gaziranih pića i mineralne gazirane vode. Velike količine ugljikova(IV) oksida troše se na proizvodnju sode i sode bikarbone.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Ugljikov(IV) oksid nastaje i u drugim kemijskim reakcijama. Odaberite reakcije u kojima će jedan od produkata biti ugljikov(IV) oksid. Za odabrane procese napišite jednadžbu kemijske reakcije služeći se aplikacijom Pisanje kemijskih jednadžbi na webu.
Točni odgovori:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Luka i Ante žele ispitati je li u podrumu Lukina djeda povećana količine ugljikova(IV) oksida. Odlučili su ponijeti ručnu svjetiljku na baterije, svijeću i šibice. Odaberite ispravan postupak koji Luka i Ante trebaju slijediti.
Želite li pokušati ponovo?

Što je suhi led?
Izgleda poput leda, hladi, ali se ne tali već sublimira. Što je to? Ugljikov(IV) oksid u čvrstom stanju. Istražite na mrežnim stranicama kako se proizvodi suhi led i u koje se svrhe koristi. Organizirajte svoj rad kao istraživački zadatak za grupu prijatelja.
Zašto ugljikov(IV) oksid može biti opasan?
Ugljikov(IV) oksid može biti opasan ako njegov volumni udio u zraku bude veći od 0,035%.
Izmjena plinova između zraka i pluća obavlja se na temelju različite količine ugljikova(IV) oksida u zraku i u plućima.
Ako se u tijelu poveća količina ugljikova(IV) oksida, krv se zakiseljava i dolazi do acidoze krvi.
pH-vrijednost krvi ne smije varirati jer je čak i malo odstupanje dovoljno da čovjek smrtno strada.
Prisutnost ugljikova(IV) oksida možemo dokazati testnim reagensom, bistrom kalcijevom lužinom koju nazivamo vapnena voda.
Uvođenjem plina ugljikova(IV) oksida u bistru kalcijevu lužinu otopina se zamuti zbog pojave bijelog kalcijeva karbonata koji se nakon kraćeg vremena istaloži.
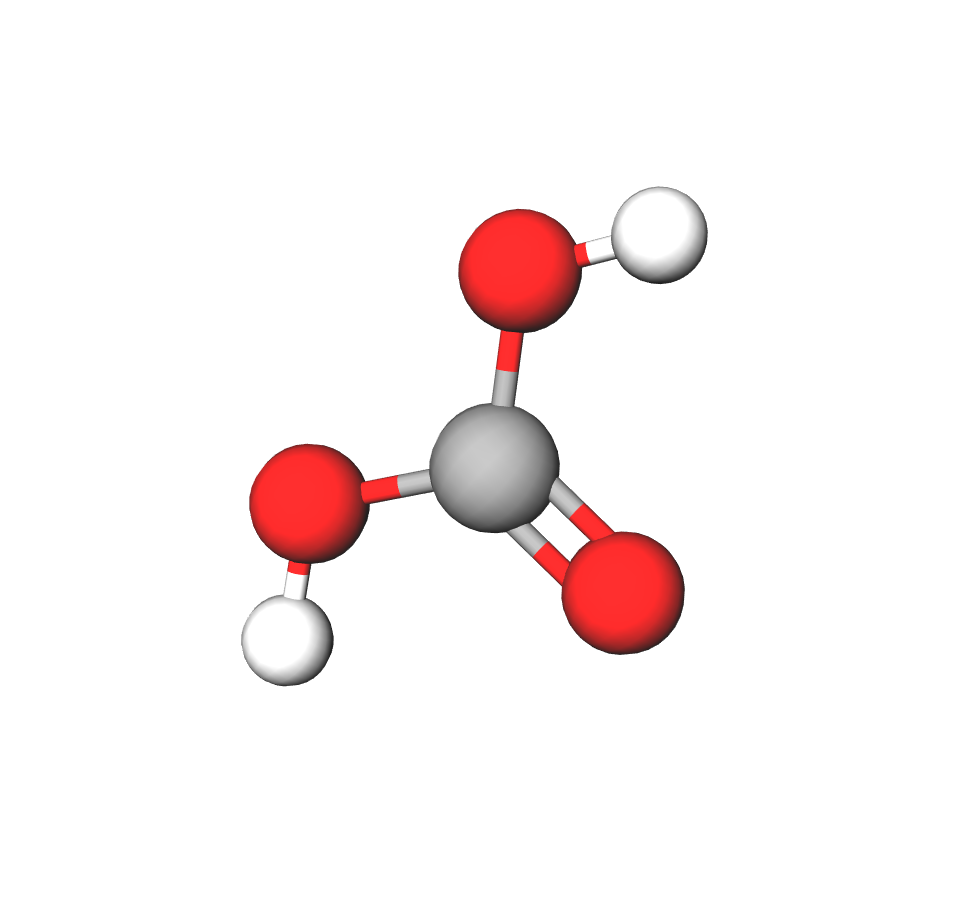
Ugljična kiselina, H2CO3
Reakcijom ugljikova(IV)oksida i vode nastaje slaba ugljična (karbonatna) kiselina.
ugljikov(IV)oksid + voda ↔ ugljična kiselina
Ugljična je kiselina nestabilna i spontano se raspada na vodu i ugljikov(IV)oksid.
Soli ugljične kiseline jesu hidrogenkarbonati i karbonati.
Primjeri: natrijev hidrogenkarbonat, (soda bikarbona), (soda).[/overflower]
Završetak
Rješavanjem interaktivnog zadataka usustavite pojmove obrađene u ovoj jedinici DOS-a.
Zašto ugljikov(IV) oksid može biti opasan?
Ugljikov(IV) oksid može biti opasan ako njegov volumni udio u zraku bude veći od 0,035 %. Izmjena plinova između zraka i pluća obavlja se na temelju različite količine ugljikova(IV) oksida u zraku i u plućima. Procesom difuzije plin spontano prelazi iz pluća u atmosferu jer ga u plućima ima više. Problem nastaje kada je u zraku povećan volumni udio ugljikova(IV) oksida pa se difuzijom isti plin i kraćeg vremena istaloži.z pluća ne može izbaciti van. S vremenom se u tijelu povećava količina ugljikova(IV) oksida što zakiseljava krv i dovodi do acidoze krvi. Budući da pH-vrijednost krvi ne smije varirati, tijekom života je stalna i kreće se od 7,35 do 7,45, pa je čak i malo odstupanje dovoljan razlog zbog kojeg čovjek može smrtno stradati.
Prisutnost ugljikova(IV) oksida možemo dokazati testnim reagensom, bistrom kalcijevom lužinom koju nazivamo vapnena voda. Uvođenjem plina ugljikova(IV) oksida u bistru kalcijevu lužinu, otopina se zamuti zbog pojave bijelog kalcijeva karbonata koji se nakon kraćeg vremena istaloži.
Ugljična kiselina,
Reakcijom ugljikova(IV) oksida i vode nastaje slaba ugljična (karbonatna) kiselina. Pri sobnoj temperaturi jedna litra vode otapa jednu litru ugljikova(IV) oksida. Otopina ima pH-vrijednost oko 4.
Ugljična je kiselina nestabilna i spontano se raspada na vodu i ugljikov(IV) oksid.
Soli ugljične kiseline jesu hidrogenkarbonati i karbonati. Primjeri: natrijev hidrogenkarbonat, , odnosno natrijev karbonat, , koji nose trivijalne nazive soda bikarbona, odnosno soda.
Na kraju…
Rješavanjem interaktivnog zadataka, usustavite pojmove obrađene u ovoj jedinici DOS-a te potom riješite interaktivni kviz.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Alotropska modifikacija ugljika kuglasta ili cjevasta oblika jest:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za život čovjeka iznimno je opasan rad automobilskih motora u zatvorenim garažama. To je zbog nastajanja:
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Pri ulasku u zatvorenu prostoriju u kojoj je povećana količina ugljikova(IV) oksida, upaljena će se svijeća ugasiti jer je ugljikov(IV) oksid manje gust od zraka.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Grafit je dobar vodič električne energije pa se zato koristi u proizvodnji:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kristalna struktura u kojoj je jedan atom ugljika povezan s četirima susjednim atomima u pravilan tetraedar odgovara:
Za život čovjeka veoma je opasno udisanje ispušnih plinova motora s unutrašnjim izgaranjem, na primjer pri radu automobilskog motora u zatvorenoj garaži. To je zato što nastaje:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za život čovjeka veoma je opasno udisanje ispušnih plinova motora s unutrašnjim izgaranjem. Primjerice, pri radu automobilskog motora u zatvorenoj garaži nastaje:
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Pri ulasku u zatvorenu prostoriju u kojoj je povećana količina ugljikova(IV) oksida upaljenu svijeću, kao indikator povećane koncentracije , treba držati visoko iznad glave jer je ugljikov(IV) oksid manje gust od zraka.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U vodi je dobro topljiv:
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?