Nemetali, oksidi nemetala i kiseline
- nabrojiti nekoliko nemetala i navesti njihova karakteristična fizikalna svojstva,
- navesti fizikalna i kemijska svojstva sumpora, oksida sumpora i sumporne kiseline,
- objasniti kako se pravilno rukuje kemijskim priborom i posuđem prilikom razrjeđivanja koncentrirane kiseline vodom,
- imenovati kemijsku formulu za sumpornu, sumporastu, klorovodičnu, ugljičnu i fosfornu kiselinu,
- obrazložiti nastajanje kiselih kiša,
- izmjeriti pH-vrijednost kiselih otopina univerzalnim indikatorom i protumačiti dobiveni rezultat,
- kemijskom jednadžbom prikazati reakciju sumpora s kisikom i reakciju oksida sumpora s vodom.
Nemetali
Nemetali koje već poznajete sigurno su kisik, dušik, vodik i klor. To su plinovi pri sobnoj temperaturi, većinom su bez boje, niskog su vrelišta i male gustoće. Ubrajamo ih u čiste elementarne tvari.
Dušik i kisik
Iako su nemetali većinom plinovite tvari, neki su nemetali pri sobnoj temperaturi u drugim agregacijskim stanjima. Tako je brom tekućina, a primjerice, jod, fosfor, ugljik i sumpor čvrste su tvari. Slika prikazuje uzorke nekih nemetala.
Sumpor – na slici gore lijevo, žute boje, koristi se pri izbjeljivanju tekstila.
Brom – u bočici, jedini nemetal u tekućem stanju pri sobnoj temperaturi.
Fosfor – na slici gore desno, može biti crveni, bijeli i crni.
Jod – na slici dolje lijevo, nalazi se u sastavu alkoholne tinkture kojom dezinficiramo rane i sl.
Ugljik – na slici dolje desno, nalazi se u grafitu obične olovke.
Sumpor se koristi pri izbjeljivanju tekstila, brom je jedini nemetal u tekućem agregacijskom stanju pri sobnoj temperaturi. Fosfor ima tri alotropske modifikacije: bijeli, crveni i crni fosfor. Jod se nalazi u sastavu alkoholne tinkture – poznatog sredstva za dezinfekciju. Ugljik ima tri alotropske modifikacije: grafit, dijamant i fuleren; na slici je prikazan grafit izvađen iz obične, školske tzv. grafitne olovke.
Nemetali
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite parove premještajući pojmove po stupcima.
kisik
koristi se pri sterilizaciji vode za piće
dušik
nalazi se u pakiranju vrećice čipsa
vodik
najlakši plin
klor
podržava gorenje
Kisik je u sastavu atmosfere, važan je za proces disanja živih bića i podržava proces gorenja tvari.
Dušik je inertni sastojak atmosfere, ne gori i ne podržava gorenje.
Vodika ima najviše u svemiru, gustoća mu je manja od gustoće zraka i najlakši je od svih plinova. Zapaljiv je, a u smjesi sa zrakom stvara eksplozivnu smjesu – plin praskavac.
Klor je žutozeleni plin neugodna mirisa, otrovan je i topljiv u vodi. Koristi se pri sterilizaciji vode za piće.
Želite li pokušati ponovo?
Sumpor
Upoznajte pobliže sumpor, nemetal koji je jedan od najstarijih poznatih elemenata.
U prirodi sumpor možemo naći u čistom, elementarnom stanju i u sastavu brojnih spojeva.
Ima ga u ugljenu i nafti, raznim stijenama te u živim bićima.
Sumpor
Upoznajte pobliže sumpor, nemetal koji je jedan od najstarijih poznatih elemenata.
U prirodi sumpor možemo naći u čistom, elementarnom stanju i u sastavu brojnih spojeva. Ima ga u ugljenu i nafti, raznim stijenama te u živim bićima.
Pogledate li uzorak sumpora, vidjet ćete da je to čvrsta tvar žute boje i bez mirisa.
Nije topljiv u vodi, ali ga možete otopiti u organskim otapalima, parafinskom ulju ili maslinovom ulju.
Pogledate li uzorak sumpora, vidjet ćete da je to čvrsta tvar žute boje i bez mirisa. Nije topljiv u vodi, ali ga možete otopiti u organskim otapalima, parafinskom ulju ili maslinovom ulju.
Kristale rompskog sumpora možete pripraviti isparavanjem otapala iz otopine sumpora u ugljikovom disulfidu.
Monoklinski sumpor, odnosno igličasti kristali sumpora, nastaje hlađenjem otopine sumpora u parafinskom ulju ili u toluenu.
Ponovite!
Oksidacija je kemijska reakcija spajanja kisika i neke druge elementarne tvari, metala ili nemetala.
Pri tom procesu najčešće sudjeluje kisik iz zraka.
Ako se pri procesu oksidacije vidi plamen i osjeća se oslobađanje topline, takav proces nazivamo još i gorenje.
Oksidi sumpora
Sumpor gori plavim plamenom.
Pri procesu gorenja sumpor se spaja s kisikom iz zraka i nastaje sumporov dioksid.
sumpor kisik sumporov dioksid
Kristale rompskog sumpora možete pripraviti isparavanjem otapala iz otopine sumpora u ugljikovom disulfidu. Monoklinski sumpor, odnosno igličasti kristali sumpora, nastaje hlađenjem otopine sumpora u parafinskom ulju ili u toluenu.
Oksidacija je kemijska reakcija spajanja kisika i neke druge elementarne tvari, metala ili nemetala. Pri tom procesu najčešće sudjeluje kisik iz zraka. Ako se pri procesu oksidacije vidi plamen i osjeća se oslobađanje topline, takav proces nazivamo još i gorenje.
Oksidi sumpora
Sumpor gori plavičastim plamenom. Pri procesu gorenja sumpor se spaja s kisikom iz zraka i nastaje sumporov dioksid.
Sumporov dioksid (ili sumporov(IV) oksid) plin je oštra i neugodna mirisa.
Otrovan je, a s vodenom parom iz zraka stvara bijeli dim.
Sumporov trioksid nastaje reakcijom kisika i sumporovog dioksida.
sumporov dioksid + kisik → sumporov trioksid
Ako sumporov dioksid ili sumporov trioksid dođu u dodir s vodom, nastaju kiseline.
sumporov dioksik + voda → sumporasta kiselina
sumporov trioksid + voda → sumporna kiselina
Sumporov dioksid ili sumporov(IV) oksid plin je oštra i neugodna mirisa, otrovan je, s vodenom parom iz zraka stvara bijeli dim (sumporasta kiselina u stanju aerosola).
Sumporov trioksid ili sumporov(VI) oksid nastaje reakcijom kisika i sumporovog dioksida.
Oba oksida sumpora reagiraju s vodom pri čemu nastaju odgovarajuće kiseline.
Navedimo još neke poznate okside nemetala. Među njima su najpoznatiji ugljikov(II) oksid i ugljikov(IV) oksid.
Ugljikov(II) oksid, , plin je bez boje i mirisa, manje je gustoće od zraka, zapaljiv je, gori plavim plamenom i slabo je topljiv u vodi. Nastaje gorenjem organskih tvari uz nedovoljan pristup zraka. Vrlo je otrovan jer blokira rad hemoglobina pa stanice ne dobivaju dovoljno kisika.
Ugljikov(IV) oksid, , plin je bez boje i mirisa, sastavni je dio atmosfere. Nastaje procesom izgaranja organskih tvari, a isto tako nastaje aerobnim disanjem živih bića. Autotrofni organizmi troše ga u procesu fotosinteze. Ugljikov(IV) oksid nije zapaljiv, ne podržava gorenje, teži je od zraka i topljiv je u vodi.
Treba naglasiti da ugljikov(IV) oksid može biti otrovan. Kod procesa vrenja mošta stvara se veća količina ugljikovog dioksida koji se zadržava u atmosferi podruma. Prilikom disanja u takvu podrumu čovjek ne može izbaciti svoj ugljikov(IV) oksid iz pluća. Krv postaje kisela i čovjek umire od acidoze. U zraku je normalni volumni udio ugljikovog(IV) oksida ispod 0,04 %. Kod vrijednosti od 1 % javlja se pospanost, kod 5 % mučnina, a u količini od 7 do 10 % ugljikov(IV) oksid izaziva kiseljenje krvi.
Istražite koja je
Upoznajte još neke okside nemetala:
1. Ugljikov monoksid, (), plin je bez boje i mirisa.
Nastaje gorenjem organskih tvari uz nedovoljan pristup zraka.
Zapaljiv je, gori plavim plamenom i slabo je topljiv u vodi.
Vrlo je otrovan jer blokira rad hemoglobina pa stanice ne dobivaju dovoljno kisika.
2. Ugljikov dioksid, (), plin je bez boje i mirisa, sastavni je dio atmosfere.
Nastaje i disanjem ljudi i životinja (udišemo kisik, a izdišemo ugljikov dioksid).
Biljke ga koriste za fotosintezu.
Nije zapaljiv, ne podržava gorenje.
Može biti otrovan: kod procesa vrenja mošta stvara se veća količina ugljikovog dioksida koji se zadržava u atmosferi podruma. Prilikom disanja u takvu podrumu čovjek ne može izbaciti ugljikov dioksid iz svojih pluća. Već kod malih koncentracija ugljikovog dioksida javlja se pospanost, zatim mučnina i na kraju smrt.
3. Dušikov monoksid, (), bezbojan je i otrovan plin.
Stvara se pri sagorijevanju goriva u automobilskim i avionskim motorima.
Ima zanimljive biološke uloge poput stvaranja svjetla kod krijesnica, širenja krvnih žila i povećanja protoka krvi bogate kisikom.
4. Dušikov(I) oksid, (), najpoznatiji je kao plin koji izaziva smijeh.
Pri udisanju tog plina javlja se i smanjena osjetljivost na bol. To je bio prvi anestetik kada je polovicom 19. stoljeća uvedena anestezija kod kirurških operacija.
Dušikov(I) oksid nije otrovan, stoga je pogodan pri proizvodnji prehrambenih proizvoda. Primjerice, koristi se kao potisni plin u bočici za šlag (slatko vrhnje).
Neki oksidi dušika i fosfora
Dušikov(II) oksid, , također je bezbojan i otrovan plin, stvara se pri sagorijevanju goriva u automobilskim i avionskim motorima. Ima zanimljive biološke uloge poput stvaranja svjetla kod krijesnica, širenja krvnih žila i povećanja protoka krvi bogate kisikom.
Dušikov(I) oksid, , najpoznatiji je kao plin koji izaziva smijeh. Pri udisanju tog plina javlja se i smanjena osjetljivost na bol. To je bio prvi anestetik kada je polovicom 19. stoljeća uvedena anestezija kod kirurških operacija. Dušikov(I) oksid inertan je i nije otrovan, stoga je pogodan pri proizvodnji prehrambenih proizvoda. Primjerice, koristi se kao potisni plin u bočici za šlag (slatko vrhnje).
Fosforov(V) oksid, , čvrsta je tvar bijele boje, bez mirisa i nije otrovna. Ima izrazito snažno svojstvo privlačenja vode pa se koristi kao dehidratacijsko sredstvo ili sredstvo za sušenje plinova.
Kiseline
Kad ste bili maleni, od sve kisele hrane vjerojatno ste najprije probali naranču ili limun. Zatim ste salatu začinili octom, a zasigurno ste čuli da neka kiselina uzrokuje karijes zuba. Naš želudac stvara klorovodičnu kiselinu koja sudjeluje u probavi hrane. Možda ste tijekom života upoznali još neke kiseline.
Prema kemijskoj podjeli tvari,
Što se događa prilikom otapanja kiseline u vodi?
Natočimo čašu čiste vode i ostavimo je da miruje na stolu. Prisjetimo se kako je građena molekula vode – u njezinu je sastavu jedan atom kisika povezan s dvama atomima vodika.
U čaši čiste vode molekule se kreću, sudaraju se međusobno kao i sa stijenkama posude.
Mali broj molekula vode doživljava promjenu u kojoj proton, , s jedne molekule vode preskače na drugu molekulu vode.
Kažemo da molekule vode elektrolitički disociraju.
To možemo prikazati ovako:
Zato možemo reći da u čaši vode postoje sljedeće čestice:
molekule vode – ,
oksonijevi ioni – , i
hidroksidni ioni – .
Pri postupku otapanja kiseline u vodi molekula kiseline disocira (rastavlja se) na katione vodika i na anione kiselinskog ostatka.
Kationi vodika koje kiselina oslobodi stvaraju oksonijeve ione s molekulama vode.
Tako se u vodenim otopinama kiselinā povećava količina oksonijevih iona, .
Primjerice, ionizaciju klorovodične kiseline prikazujemo ovako:
U čaši čiste vode molekule se kreću, sudaraju se međusobno kao i sa stijenkama posude. Mali broj molekula vode doživljava promjenu u kojoj proton, , s jedne molekule vode preskače na drugu molekulu vode. Kažemo da molekule vode elektrolitički disociraju. To možemo prikazati ovako:
Zato možemo reći da u čaši vode postoje sljedeće čestice: molekule vode, ,
Pri postupku otapanja kiseline u vodi molekula kiseline disocira na katione vodika i na anione kiselinskog ostatka. Kationi vodika koje kiselina oslobodi stvaraju oksonijeve ione s molekulama vode. Tako se u vodenim otopinama kiselinā povećava količina oksonijevih iona, . Primjerice, ionizaciju klorovodične kiseline prikazujemo ovako:
Vodikovi odnosno oksonijevi ioni uzrokuju kiselost otopine. Prisutnost kiselina u nekom uzorku tvari možemo dokazati indikatorima. Najpoznatiji su
Univerzalnim indikatorskim papirićima
Neki su prirodni indikatori: sok od crvenog kupusa, crveno vino, crni čaj.
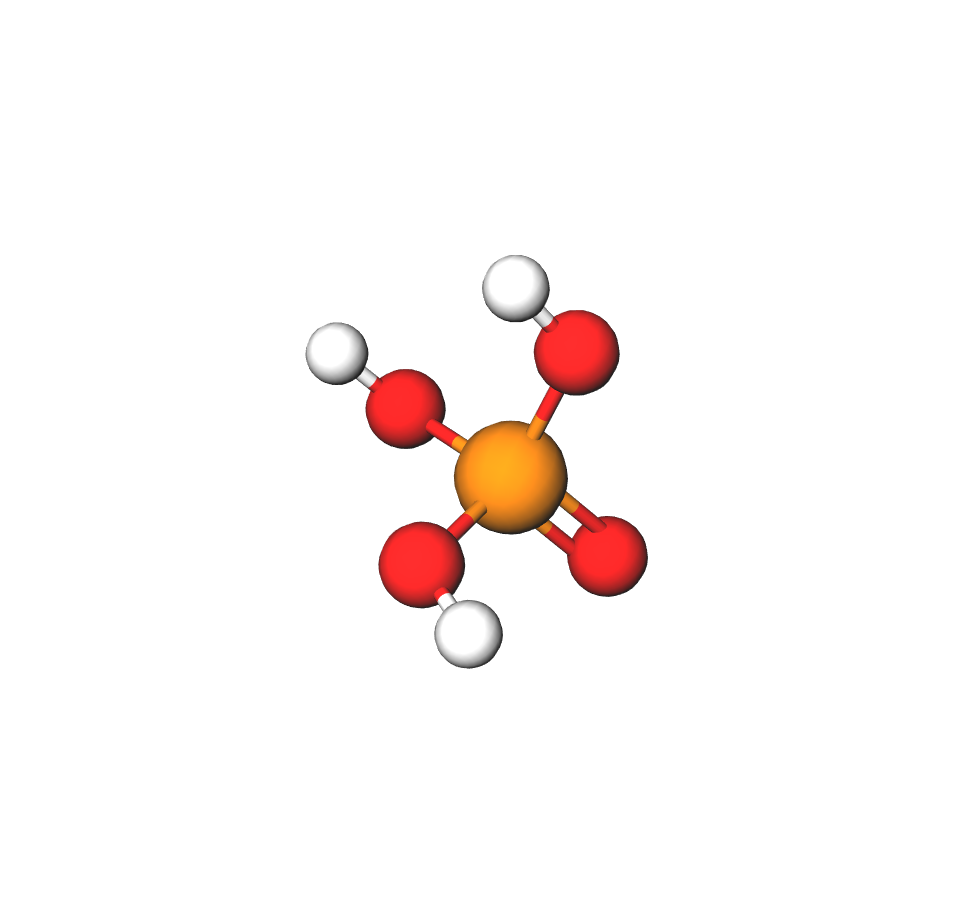
Sumporna kiselina, , bezbojna je uljasta tekućina
gustoće . Talište joj je na , a vrelište na . Ima nagrizajuća svojstva i karakterističan miris.
Organske tvari u dodiru sa sumpornom kiselinom pocrne jer ih ona kemijski rastavlja na ugljik i vodu. Promotrite što se zbiva kada se na šećer (organsku tvar) ulije koncentrirana sumporna kiselina.
Sumporna kiselina
- bezbojna uljasta tekućina
- ima nagrizajuća svojstva
- koristimo je za proizvodnju umjetnih gnojiva, sredstava za pranje, boja, lijekova, ljepila, željeza i čelika, a najčešće se koristi kao elektrolit u akumulatorima
Oprez!
Boca sumporne kiseline mora se dobro začepiti staklenim ili plastičnim čepom.
Kažemo da je sumporna kiselina jako dehidratacijsko sredstvo.
Pravilno razrjeđivanje koncentriranih kiselina
Sve koncentrirane kiseline pravilno razrjeđujemo destiliranom vodom tako da
kiselinu ulijevamo u vodu, a nikako vodu u kiselinu.
Zapamtite kraticu: KuV – kiselinu u vodu!!!
Kiselina treba teći polako i u tankom mlazu, najbolje preko staklenog štapića u čašu.
Povremeno promiješamo otopinu štapićem. Pri tome ćemo opaziti oslobađanje topline, zato kažemo da je proces egzoterman.
Čista sumporna kiselina vrlo je sklona na sebe vezati vodu pri čemu nastaju hidrati.
Obrazložite zašto je bocu sumporne kiseline potrebno dobro začepiti staklenim ili plastičnim čepom.
Sumpornu kiselinu koristimo za proizvodnju umjetnih gnojiva, sredstava za pranje, boja, lijekova, ljepila, željeza i čelika, a najčešće se koristi kao elektrolit u akumulatorima.
Pravilno razrjeđivanje koncentriranih kiselina
Sve koncentrirane kiseline pravilno razrjeđujemo destiliranom vodom tako da kiselinu ulijevamo u vodu (KuV). Kiselina treba teći polako i u tankom mlazu, najbolje preko staklenog štapića u čašu. Povremeno promiješamo otopinu štapićem. Pri tome ćemo opaziti oslobađanje topline, stoga kažemo da je proces egzoterman.
Pozorno promotrite sljedeći videozapis. Je li to pravilan ili nepravilan način razrjeđivanja kiseline vodom? Objasnite svoja opažanja.
Prikazani postupak nije ispravan način razrjeđivanja kiseline vodom.
Pri nalijevanju vode u kiselinu (VuK) dolazi do naglog isparavanja vode zbog velike topline koja se oslobađa.
Nastala vodena para uzrokuje prskanje kapljica kiseline.
Upoznajte još neke kiseline!
Klorovodična kiselina,
- bezbojna tekućina koja lako hlapi
- nagrizajuća je i otapa se u vodi
- sastojak je želučanog soka, a u domaćinstvu je koristimo za uklanjanje kamenca (naziv: solna kiselina)
Oprez!
Ako ovu kiselinu koristite u kućanstvu, pazite da ne dođe u dodir sa sredstvima za izbjeljivanje i dezinfekciju jer se tada stvara otrovan plin klor.
Fosforna kiselina,
- prozirna i kristalna čvrsta tvar, bez boje i mirisa
- otapa se u vodi
- nagrizaja je i nadražuje
- koristimo je za obradu željeznih površina, za učvršćivanje hrđe prije bojenja, ali najpoznatija je njezina upotreba za zakiseljavanje bezalkoholnih pića
Dušična kiselina,
- bezbojna tekućina u čistome stanju
- ako poprimi boju slame, znači da se dio molekula dušične kiseline raspao na dušikov dioksid
- koristi se u proizvodnji lijekova, boja, mineralnih gnojiva i eksploziva
Prikazani postupak nije ispravan način razrjeđivanja kiseline vodom. Pri nalijevanju vode u kiselinu (VuK) dolazi do naglog isparavanja vode zbog velike osobođene topline. Nastala vodena para uzrokuje prskanje kapljica kiseline.
Osim sumporne kiseline u kemijskom laboratoriju rabimo i neke druge kiseline. Upoznajte neke od njih.
Klorovodična kiselina, , bezbojna je tekućina, karakterističnog mirisa, lako hlapi, nagrizajuća je i otapa se u vodi. Sastojak je želučanog soka, a u domaćinstvu je koristimo za uklanjanje kamenca. U trgovinama dolazi pod nazivom solna kiselina. Ako ovu kiselinu koristite u kućanstvu, pazite da ne dođe u dodir sa sredstvima za izbjeljivanje i dezinfekciju jer se tada stvara otrovan plin klor.
Fosforna kiselina, , prozirna je i kristalna čvrsta tvar, bez boje i mirisa. Jako je higroskopna i otapa se u vodi. U kemijskom laboratoriju naći ćete je kao sirupastu vodenu otopinu koja nagriza i nadražuje. Koristimo je za obradu željeznih površina, za učvršćivanje hrđe prije bojenja, ali najpoznatija je njezina upotreba za zakiseljavanje bezalkoholnih pića. Fosforna kiselina stvara tri vrste soli: fosfate, hidrogenfosfate i dihidrogenfosfate.
Dušična kiselina, , bezbojna je tekućina u čistome stanju, a ako poprimi boju slame, to znači da se dio molekula dušične kiseline raspao na dušikov(IV) oksid. Koristi se u proizvodnji lijekova, boja, mineralnih gnojiva i eksploziva. Soli dušične kiseline jesu nitrati.
Još neke kiseline:
sumporasta kiselina,
dušikasta kiselina,
ugljična ili karbonatna kiselina,
mravlja ili metanska kiselina,
octena ili etanska kiselina, .
Kisele kiše
Izgaranjem fosilnih goriva nastaju oksidi sumpora i dušika koji u atmosferi reagiraju s vlagom i tako stvaraju kiseline. Dok je pH-vrijednost obične kiše 5,5, pH-vrijednost kisele kiše jest oko 4. To znači da kisela kiša ima oko četrdeset puta više kiseline od obične kišnice. Kisela kiša oštećuje lišće i koru biljaka, uništava građevine od vapnenca, u jezerima i rijekama uzrok je izumiranja životinja, a iz tla oslobađa teške metale koji potom dospijevaju u podzemne vode.

Jesu li kisele kiše globalni ili lokalni problem?
Potražite na mrežnim stranicama, primjerice, portalu Pixabay, fotografije objavljene pod licencijom Creative Commons, kojima ćete potkrijepiti činjenice o kiselim kišama kao globalnom ekološkom problemu. Fotografije koje vaš razred prikupi upotrijebite za izradu prezentacije o kiselim kišama i posljedicama takvih kiša na okoliš i zdravlje živih bića. Prezentaciju možete izraditi u digitalnom alatu Zoho Show. U dogovoru s administratorom postavite prezentaciju na mrežne stranice škole i tako upoznajte i ostale učenike s temom.
Povlačenjem elemenata uskladi odgovarajuće parove.
Spojite parove premještajući pojmove po stupcima.
Spojite nemetale na lijevoj strani s njihovim svojstvima na desnoj strani.
SUMPOR
u tekućem je stanju na sobnoj temperaturi
BROM
žute boje
FOSFOR
nalazi se u grafitu obične olovke
UGLJIK
može biti crvene, bijele i crne boje
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Sumpor je topljiv u vodi.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Sumporov je dioksid…
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kad kiselinu razrjeđujemo vodom…
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Izdvojite uljeza.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji nemetal nije u plinovitu stanju?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja je od navedenih kiselina u čistom stanju kruta tvar?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kiselost vodenih otopina uzrokuju:
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Koncentrirana sumporna kiselina jako je higroskopna. Razara tvari organskog podrijetla tako što iz njih uzima vodu. Upija vodu i iz zraka. Zato boce sa sumpornom kiselinom treba držati začepljene staklenim ili plastičnim čepom.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Odaberite pogrešne tvrdnje.
Želite li pokušati ponovo?