Elektrolizni članci
- opisati elektrolizni članak
- razlikovati galvanski od elektroliznog članka
- opisati postupak elektrolize
- razlikovati elektrolize talina i vodenih otopina nekih soli
- primijeniti Faradayev zakon za izračunavanje promjene množine tvari na elektrodama u jednome članku ili serijski spojenim člancima
Uvod
U talinama i vodenim otopinama elektrolita nalaze se slobodni, pokretljivi ioni.
Oni se pod utjecajem električnog polja gibaju prema suprotno nabijenoj elektrodi.
Na elektrodama u elektroliznom članku zbivaju se redoks reakcije.
U galvanskom članku istosmjerna struja nastaje.
U elektroliznom članku istosmjerna struja se troši.
Elektrolizni članci
Uvod
U talinama i vodenim otopinama elektrolita nalaze se slobodni, pokretljivi ioni, koji se pod utjecajem električnog polja gibaju prema suprotno nabijenoj elektrodi. Na elektrodama u elektroliznom članku zbivaju se redoks-reakcije. U galvanskom članku istosmjerna struja nastaje, dok se u elektroliznom članku ona troši.
Elektrolizni članci
Rastavljanje tvari djelovanjem električne struje zove se elektroliza.
Elektroliza je redoks reakcija koja se ne zbiva spontano.
Zbiva se isključivo djelovanjem električne struje.
Elektroliza se provodi u elektroliznom članku u kojem se električna energija pretvara u kemijsku.
Elektrolizni članak se sastoji od posude s elektrolitom, u koji su uronjene dvije elektrode spojene na izvor istosmjerne struje.
Anoda se spaja na pozitivni pol izvora električne struje
Katoda se spaja na negativni pol izvora električne struje.
Elektrode mogu biti od istovrsnoga (grafitne olovke) ili različitoga materijala, ovisno o elektrolitu.
Elektrolit može biti talina ili vodena otopina neke soli, kiseline ili lužine.
Nakon što se elektrode urone u elektrolit i spoje na izvor istosmjerne struje, dolazi do procesa elektolize.
Na anodi dolazi do
Rastavljanje tvari djelovanjem električne struje zove se elektroliza. Elektroliza je redoks-reakcija koja se ne zbiva spontano, već isključivo djelovanjem električne struje. Provodi se u elektroliznom članku u kojem se električna energija pretvara u kemijsku.
Elektrolizni članak se sastoji od posude s elektrolitom, u koji su uronjene dvije elektrode spojene na izvor istosmjerne struje.
Anoda se spaja na pozitivni pol, a katoda na negativni pol izvora električne struje.
Elektrode mogu biti od istovrsnoga (grafitne olovke) ili različitoga materijala, ovisno o elektrolitu.
Elektrolit može biti talina ili vodena otopina neke soli, kiseline ili lužine.
Nakon što se elektrode urone u elektrolit i spoje na izvor istosmjerne struje dolazi do procesa elektolize.
Na anodi dolazi do
Ponovimo još jednom reakcije na elektrodama pri elektrolizi taline olovova (II) bromida (PbBr2).
katoda (–): redukcija
anoda (+): oksidacija
Olovov (II) bromid (PbBr2) se djelovanjem električne struje razložio na olovo (Pb) i brom (Br2).
Elekroliza taline natrijeva klorida
Natrijev klorid, NaCl (s) je ionski kristal.
Zagrijavanjem u metalnom lončiću iznad 800 °C, natrijev klorid (NaCl) se rastali.
Na taj način nastaje talina, elektrolit u kojem se nalaze natrijevi (Na+) i kloridni (Cl–) ioni.
Ioni se slobodno gibaju u svim smjerovima.
U talinu se urone grafitne elektrode.
Grafitne elektrode se spoje električnim vodičima na bateriju.
Ponovimo još jednom reakcije na elektrodama pri elektrolizi taline olovova(II) bromida.
katoda (–):
anoda (+):
Olovov(II) bromid se djelovanjem električne struje razložio na olovo i brom.
Elekroliza taline natrijeva klorida
Natrijev klorid, NaCl (s), je ionski kristal koji se zagrijavanjem u metalnom lončiću iznad 800 °C rastali. Na taj način nastaje talina, elektrolit u kojem se nalaze natrijevi i kloridni ioni, koji se slobodno gibaju u svim smjerovima.
U talinu se urone grafitne elektrode i spoje se električnim vodičima na bateriju.
Nakon zatvaranja strujnoga kruga dolazi do usmjerenoga gibanja iona prema suprotno nabijenim elektrodama.
Natrijevi ioni, Na+ (kationi) usmjeravaju se prema negativnoj (–) elektrodi, katodi.
Kloridni ioni, Cl– (anioni) usmjeravaju se prema pozitivnoj (+) elektrodi, anodi.
Na katodi se natrijevi ioni, , reduciraju.
Na anodi se kloridni ioni, , oksidiraju.
Elektrolizu taline natrijeva klorida () možemo prikazati reakcijom:
katoda (–):
anoda (+):
katoda (–):
anoda (+):
Natrijev klorid () se djelovanjem električne struje razložio na natrij () i klor ().
Elektroliza vode
Elektrolizu vode najbolje je izvesti u Hofmannovu aparatu s platinskim elektrodama jer se može pratiti kvalitativni i kvantitativni tijek reakcije.
Voda je slabi elektrolit.
U vodu je potrebno dodati malo razrijeđene sumporne kiseline (H2SO4) da bi joj se povećala vodljivost.
Nakon zatvaranja strujnoga kruga dolazi do usmjerenoga gibanja iona prema suprotno nabijenim elektrodama. Natrijevi ioni, Na+ (kationi) usmjeravaju se prema negativnoj elektrodi, katodi, a kloridni ioni, Cl– (anioni) prema pozitivnoj elektrodi, anodi. Na katodi se Na+ ioni reduciraju, a na anodi se Cl– ioni oksidiraju.
Elektrolizu taline natrijeva klorida možemo prikazati reakcijom:
katoda (–):
anoda (+):
katoda (–):
anoda (+):
Natrijev klorid se djelovanjem električne struje razložio na natrij i klor.
Elektroliza vode
Elektrolizu vode najbolje je izvesti u Hofmannovu aparatu s platinskim elektrodama jer se može pratiti kvalitativni i kvantitativni tijek reakcije. Voda je slabi elektrolit, pa je potrebno u nju dodati malo razrijeđene sumporne kiseline da bi joj se povećala vodljivost.
Pri elektrolizi vode na elektrodama se odvijaju sljedeće reakcije:
katoda (–):
anoda (+):
katoda (–):
anoda (+):
| { | |||
Elektrolizom vode nastaju vodik (H2) i kisik (O2).
Pri elektrolizi vode na elektrodama se odvijaju sljedeće reakcije:
katoda(–):
anoda (+):
katoda(–):
anoda (+):
| { | |||
Elektrolizom vode nastaju vodik i kisik.
Elektroliza vodene otopine natrijeva klorida
U vodenim se otopinama, osim molekula vode, nalaze i ioni disociranih soli, kiselina ili lužina.
Tada se na elektrodama reduciraju ili oksidiraju oni ioni ili molekule za čiju je reakciju potrebna manja (<) energija.
Pozorno pogledajte videozapis koji prikazuje elektrolizu vodene otopine natrijeva klorida (NaCl).
Elektroliza vodene otopine natrijeva klorida
U vodenim se otopinama, osim molekula vode, nalaze i ioni disociranih soli, kiselina ili lužina. Tada se na elektrodama reduciraju ili oksidiraju oni ioni ili molekule za čiju je reakciju potrebna manja energija.
Pozorno pogledajte videozapis koji prikazuje elektrolizu vodene otopine natrijeva klorida.
Standardni redukcijski potencijal natrija
(Eº (Na+/Na) = – 2,71 V) negativniji (–) u odnosu na standardni redukcijski potencijal vode (Eº (H2O/H2) = – 0,83 V).
Zbog toga na katodi dolazi do redukcije molekula vode.
Stoga se elektroliza vodene otopine natrijeva klorida (NaCl) prikazuje jednadžbama kemijskih reakcija:
katoda (–):
anoda (+):
Produkti elektrolize zasićene vodene otopine natrijeva klorida (NaCl) su:
- vodik (H2) na katodi,
- klor (Cl) na anodi,
- natrijeva lužina (NaOH).
Budući da je standardni redukcijski potencijal natrija
(Eº (Na+/Na) = – 2,71 V) negativniji u odnosu na standardni redukcijski potencijal vode (Eº (H2O/H2) = – 0,83 V), na katodi dolazi do redukcije molekula vode. Stoga se elektroliza vodene otopine natrijeva klorida prikazuje jednadžbama kemijskih reakcija:
katoda (–):
anoda (+):
Produkti elektrolize zasićene vodene otopine natrijeva klorida su vodik, klor i natrijeva lužina.
Elektroliza vodenih otopina soli
Elektrolizom vodenih otopina soli u kojima se nalaze kationi alkalijskih i zemnoalkalijskih metala te aluminijevi ili amonijevi kationi, na katodi će se reducirati molekule vode.
Ako se u vodenim otopinama soli nalaze anioni u kojima je oksidacijski broj središnjeg atoma maksimalan (npr. oksidacijski broj atoma sumpora (S) u sulfatnom ionu je VI), na anodi će se oksidirati molekule vode.
| kationi | anioni |
|---|---|
| , , , ,
, , , , , |
, ,
|
| katoda(–):
|
anoda (+):
|
| anoda (+):
|
Elektroliza vodenih otopina soli
Elektrolizom vodenih otopina soli u kojima se nalaze kationi alkalijskih i zemnoalkalijskih metala te aluminijevi ili amonijevi kationi, na katodi će se reducirati molekule vode.
Ako se u vodenim otopinama soli nalaze anioni u kojima je oksidacijski broj središnjeg atoma maksimalan (npr. oksidacijski broj atoma sumpora u sulfatnom ionu je VI), na anodi će se oksidirati molekule vode.
| kationi | anioni |
|---|---|
| , , , ,
, , , , , |
, ,
|
| katoda(–):
|
anoda (+):
|
| anoda (+):
|
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U elektroliznom članku:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom vodene otopine kalijeva sulfata (K2SO4) na anodi će nastati:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom vode:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za elektrolizu vodene otopine bakrova (II) klorida (CuCl2) s grafitnim elektrodama točna je tvrdnja
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom taline kalcijeva klorida ():
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Natrijeva lužina (NaOH) se dobiva:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U elektroliznom članku:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom vodene otopine kalijeva sulfata na anodi će nastati:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom vode:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Za elektrolizu vodene otopine bakrova(II) klorida s grafitnim elektrodama točna je tvrdnja:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Elektrolizom taline kalcijeva klorida:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Natrijeva lužina se dobiva:
Želite li pokušati ponovo?
Kvantitativni odnosi pri elektrolizi
Kvantitativne odnose pri elektrolizi ispitivao je Michael Faraday.
On je dokazao da postoji izravna kvantitativna veza između mase izlučene tvari na elektrodi i ukupnog naboja koji prođe kroz elektrolizni članak.
Kvantitativni odnosi pri elektrolizi
Kvantitativne odnose pri elektrolizi ispitivao je Michael Faraday i dokazao da postoji izravna kvantitativna veza između mase izlučene tvari na elektrodi i ukupnog naboja koji prođe kroz elektrolizni članak.
Michael Faraday
Engleski kemičar i fizičar Michael Faraday, 1791-1867.
Faraday se smatra najvećim od svih eksperimentalnih fizičara.
Godine 1825. otkrio je spoj nazvan benzen (C6H6).
Poznat je po studijama elektrolize i elektromagnetskih pojava.
Potonji su stvorili pozadinu za jedinstvenu elektromagnetsku teoriju koju je matematički opisao škotski fizičar James Maxwell.
Osmislio je prvi električni motor i druge električne uređaje kao što su transformatori i dinamo.
Michael Faraday
Engleski kemičar i fizičar Michael Faraday, (1791.– 1867.) smatra se najvećim od svih eksperimentalnih fizičara.
Godine 1825. otkrio je spoj nazvan benzen, ali je poznat po studijama elektrolize i elektromagnetskih pojava. Potonji su stvorili pozadinu za jedinstvenu elektromagnetsku teoriju koju je matematički opisao škotski fizičar James Maxwell.
Osmislio je prvi električni motor i druge električne uređaje kao što su transformatori i dinamo.
Faradayevi zakoni elektrolize
I. Faradayjev zakon:
Masa tvari (m) izlučena na elektrodi proporcionalna je množini (n) elektriciteta koja je prošla kroz elektrolit.
II. Faradayjev zakon:
Množine tvari (n) izlučene na elektrodama (serijski spojenih elektrolizera) istom
množinom (n) elektriciteta odnose se obrnuto proporcionalno broju izmijenjenih
elektrona u tim reakcijama.
Množina tvari (n) koje nastanu elektrolizom ovisi o:
- električnom naboju, Q, koji proteče kroz elektrolizer,
- vremenu trajanja elektrolize (t)
- broju elektrona koji sudjeluju u redoks-reakciji, ( z )
gdje je:
– množina tvari
– električni naboj
– broj elektrona koji sudjeluju u redoks-reakciji
- Faradayeva konstanta
Množina (n) električnog naboja jednaka (=) je umnošku (∙) jakosti (I) električne struje i vremenu trajanja elektrolize, t
Električni naboj koji prenosi 1 mol elektrona naziva se Faradayeva [Faradejeva] konstanta, F
Njezina vrijednost jednaka (=) je umnošku (∙) broja elektrona u jednom molu elektrona, , i naboju jednoga elektrona.
Faradayeva konstanta
Faradayevi zakoni elektrolize
I. Faradayjev zakon: Masa tvari izlučena na elektrodi proporcionalna je množini elektriciteta koja je prošla kroz elektrolit.
II. Faradayjev zakon: Množine tvari izlučene na elektrodama (serijski spojenih elektrolizera) istom množinom elektriciteta odnose se obrnuto proporcionalno broju izmijenjenih elektrona u tim reakcijama.
Množina tvari koje nastanu elektrolizom ovisi o električnom naboju, , koji proteče kroz elektrolizer, o vremenu trajanja elektrolize i o broju elektrona koji sudjeluju u redoks-reakciji, .
gdje je:
– množina tvari
– električni naboj
– broj elektrona koji sudjeluju u redoks-reakciji
- Faradayeva konstanta
Množina električnog naboja jednaka je umnošku jakosti električne struje, , i vremenu trajanja elektrolize, .
Električni naboj koji prenosi 1 mol elektrona naziva se Faradayeva [Faradejeva] konstanta, . Njezina vrijednost jednaka je umnošku broja elektrona u jednom molu elektrona, , i naboju jednoga elektrona.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kolika je masa (m) nikla (Ni) izlučena na elektrodi iz vodene otopine niklova (II) klorida (NiCl2)?
Kroz elektrolizni članak 35 minuta (t) teče struja jakosti 1,50 ampera (I).
t = 35 min
I = 1,50 A
m (Ni) = ?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kolika je masa nikla izlučena na elektrodi iz vodene otopine niklova(II) klorida ako kroz elektrolizni članak 35 minuta teče struja jakosti 1,50 ampera.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?

Serijski su povezana tri elektrolizna članka.
Množinska koncentracija (c) svih elektrolita je 1,00 mol/L.
Koja će se masa (m) srebra (Ag), nikla (Ni) i kroma (Cr) izlučiti na katodi uz jednaku (=) količinu naboja, Q = 96 500 C?
Zadano je :
Q =96500 C
Traži se:
m ()=?
m ()=?
m ()=?
Korak 1.
Napišu se parcijalne jednadžbe redukcije za svaki elektrolizer.
K(–)
K(–)
K(–)
Korak 2.
Na temelju parcijalnih jednadžbi redukcije može se zaključiti da na katodi nastaje 1 mol srebra (Ag), mola nikla (Ni) i mola kroma (Cr).
Odgovor:
U serijski spojenom elektrolizeru uz istu količinu naboja (Q) izlučit će se 107,9 g srebra (Ag), 29,3 g nikla (Ni) i 17,3 g kroma (Cr).
Rješeni primjer 1.
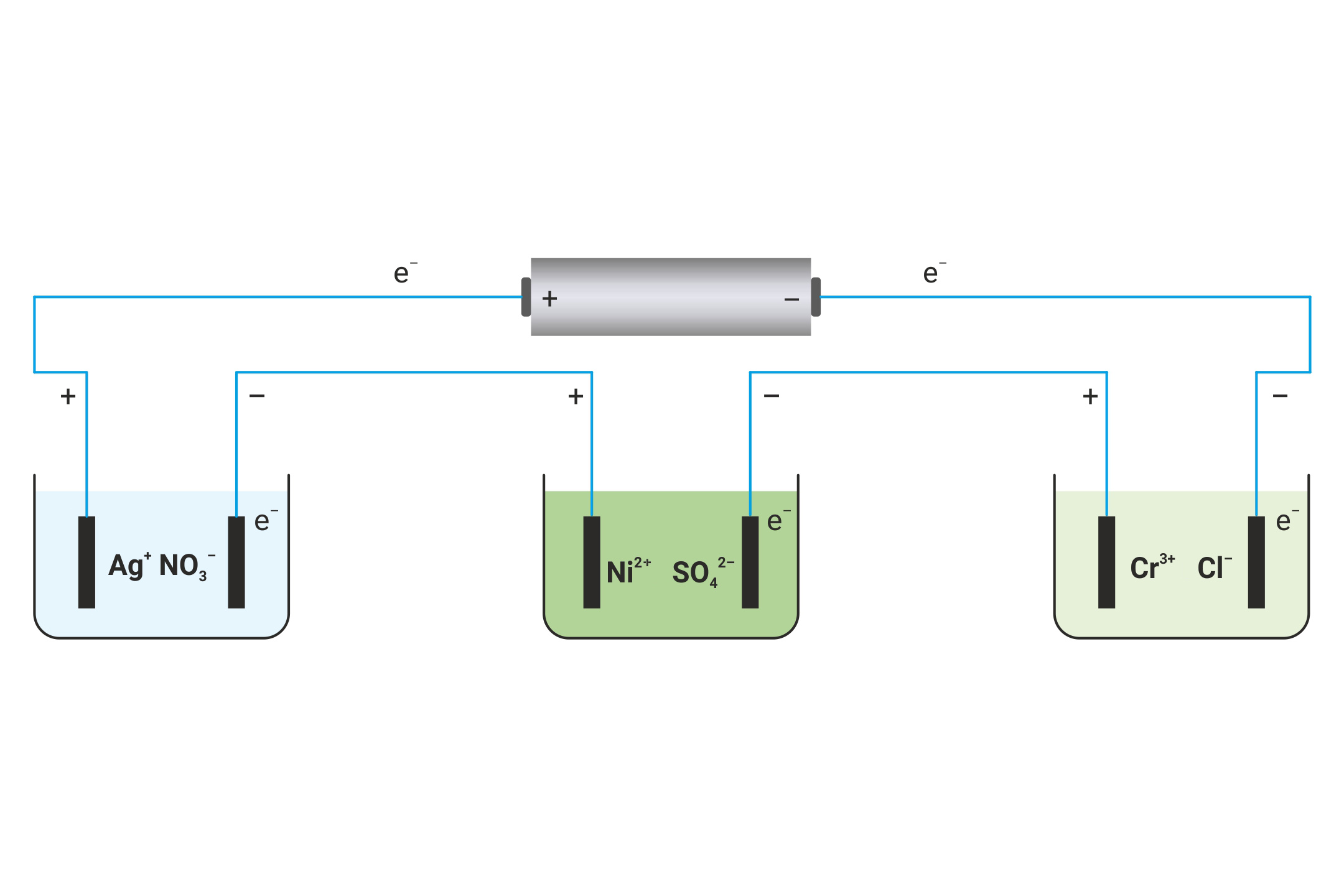
Serijski su povezana tri elektrolizna članka. Množinska koncentracija svih elektrolita je .
Koja će se masa srebra, nikla i kroma izlučiti na katodi uz jednaku količinu naboja, ?
Zadano je:
Traži se:
Korak 1.
Napišu se parcijalne jednadžbe redukcije za svaki elektrolizer.
K(–)
K(–)
K(–)
Korak 2.
Na temelju parcijalnih jednadžbi redukcije može se zaključiti da na katodi prvog elektroliznog članka nastaje 1 mol atoma Ag, na katodi drugog mola atoma Ni i na katodi trećeg elektroliznog članka mola atoma Cr.
Odgovor:
U serijski spojenim elektroliznim člancima, uz istu količinu naboja, izlučit će se 107,9 g srebra, 29,3 g nikla i
17,3 g kroma.
Na kraju…
Riješite kviz!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliki je naboj (Q) potreban za redukciju 2,5 mola (n) kalcijevih iona ()?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja tvrdnja nije pravilna za elektrolizu vodene otopine bakrova (II) klorida (CuCl2)?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliki je naboj (Q) potreban za redukciju 1,5 mola (n) kromovih (Cr3+) iona?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliki je naboj potreban za redukciju 2,5 mola kalcijevih iona?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja tvrdnja nije pravilna za elektrolizu vodene otopine bakrova(II) klorida?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliki je naboj potreban za redukciju 1,5 mola iona?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?