

Jednom su pitali fizičara i nobelovca Richarda Feynmana: "Ako se u nekakvoj kataklizmi unište sve znanstvene spoznaje i samo se jedna rečenica prenese na sljedeći naraštaj, koja bi izjava sadržavala najviše informacija u najmanje riječi?" Odgovorio je: "Vjerujem da je to atomska hipoteza prema kojoj se sve stvari sastoje od atoma – sitnih čestica koje se neprestano gibaju privlačeći jedna drugu kada su na maloj udaljenosti, a odbijajući se međusobno kada su stisnute jedna uz drugu."
Molekula je najmanja čestica neke tvari koja određuje kemijska svojstva te tvari. Ona može biti sastavljena od jednog ili više atoma koji se okupljaju u molekule. Na primjer, molekula helija
sastavljena je od jednog atoma helija, molekula dušika
sastavljena je od dvaju atoma dušika, molekula vode
sastavljena je od dvaju atoma vodika i jednog atoma kisika, molekula amonijaka
sastavljena je od jednog atoma dušika i triju atoma vodika itd.
Atom je čestica koja svojom strukturom daje obilježje određenome kemijskom elementu.
U prirodi se materija nalazi u trima agregacijskim stanjima: čvrstom, tekućem i plinovitom.
Čvrsta tijela imaju stalan oblik jer su molekule od kojih su ta tijela sastavljena vezane jakim vezama. Mada su čvrsto vezane, molekule mogu titrati oko svojih ravnotežnih položaja zato što veze među njima nisu krute nego ih zamišljamo kao elastične opruge.
Tekućine su sastavljene od molekula koje su, u odnosu prema veličini čestica, vrlo blizu jedna drugoj i koje se neprestano gibaju u svim smjerovima. Gotovo je nemoguće da se mogu još više približiti jedna drugoj pod utjecajem vanjskih sila. Za tekućine kažemo da su nestlačive. Molekule tekućine zbog svojega gibanja potpuno popunjavaju prostor u kojemu se nalaze pa tekućina poprima oblik posude u kojoj se nalazi.

Plinovi nemaju stalan oblik ni stalan volumen i popunjavaju prostor koji im je dostupan. Razmaci susjednih molekula, u odnosu prema veličinama čestica plina su veliki. Zbog toga su i sile među molekulama vrlo slabe. Molekule se u plinovima gibaju u svim smjerovima. Takvo gibanje nazivamo kaotično ili nasumično gibanje.
Škotski botaničar Robert Brown (1773. – 1858.) otkrio je mikroskopom oko 1820. godine kako se čestice peluda raspršene u tekućini neprekidno kaotično gibaju. Ta je pojava po njemu nazvana Brownovo gibanje. Čestice se međusobno elastično sudaraju, a njihovi sudari sa stijenkama posude također su elastični. Pogledajte videosnimke opažanja molekularnoga gibanja u suspenziji kapljice mlijeka i vode.
Nasumično gibanje čestica naziva se Brownovo gibanje. Ono je prouzročeno neuređenim termičkim gibanjem molekula plina koje se nasumično sudaraju s česticama plina.
Usporedite gibanja većih i manjih čestica u suspenziji. Manje čestice gibaju se brže i imaju veće pomake. Što je uzrok tim gibanjima?
Sudaranja između čestica.
Pokrenite videosnimku PhET simulacije Brownova gibanja
S pomoću pumpe generirano je dvadeset čestica manje mase i jedna čestica veće mase. Opišite gibanja čestica.
Čestice se gibaju nasumično, u svim smjerovima.
Postoji li razlika u gibanju manjih i većih čestica, posebno one jedne veće čestice?
Manje se čestice gibaju brže, međusobno se sudaraju, sudaraju se sa stijenkama posude i s većom česticom. I veća se čestica giba u svim smjerovima, ali su njezini pomaci između dviju promjena smjera gibanja znatno manji i slabiji nego pomaci manjih čestica.
Pokušajte na papiru iscrtati stazu po kojoj se veća čestica giba. Kakva je ona?
Izlomljena, cik-cak linija.
Što je uzrok gibanju veće čestice?
Sudari s manjim česticama. Ako je u nekom vrlo kratkom razdoblju broj naleta manjih čestica na veću česticu u nekom smjeru veći, veća će se čestica gibati u tom smjeru. Vrlo će brzo broj naleta biti veći u nekome drugom smjeru i veća će čestica promijeniti smjer gibanja.
Pri kraju videosnimke povećala se temperatura. Kakve su sada brzine gibanja čestica?
Čestice se gibaju većim brzinama.
U čvrstim tvarima, plinovima i tekućinama može doći do rasprostiranja tvari zbog razlike u njihovoj koncentraciji. Kod tekućina i plinova takvo rasprostiranje tvari nastaje spontanim termičkim gibanjem molekula, dok se koncentracija ne izjednači. Kod čvrstih tvari, atomi i ioni mijenjaju mjesta u kristalnoj rešetci. Taj proces događa se sporije nego u tekućinama ili plinovima.
Pojava karakteristična za plinove, tekućine i čvrste tvari pri kojoj dolazi do rasprostiranja tvari zbog razlike u njihovoj koncentraciji naziva se difuzija.

U čašama se nalazi jednaka količina vode. U svaku čašu kapnite kap tinte. Opišite opažanja.
Dogodila se difuzija tinte u vodi.
Pogledajmo pojavu difuzije u tekućini u pokusu prikazanom u videosnimci.
Je li raspodjela tinte jednaka u objema čašama?
U jednoj od čaša tinta se brže rasprostire.
Zašto? O čemu ovisi brzina rasprostiranja (difuzije)? Po čemu se razlikuju vode u čašama?
Izmjerite temperature vode u čašama. U čaši u kojoj su se čestice tinte brže raspršile, temperatura vode je veća. Brzina čestica, odnosno srednja vrijednost njihovih kinetičkih energija, povećava se s temperaturom. Pri većoj temperaturi čestice se brže raspršuju.
U čašu s vrućom vodom stavite vrećicu voćnog čaja tamne boje ili indijskoga crnog čaja. Ostavite vrećicu nekoliko minuta u vrućoj vodi i promatrajte što se događa. Nemojte miješati vodu niti pomicati vrećicu u vrućoj vodi. Opišite nastalu pojavu.
U čvrstim tijelima i tekućinama molekule se međusobno privlače. Pogledate li kapljice vode koje kapaju iz zatvorene slavine, primijetit ćete kako se kapljica drži za slavinu i opire sili teži. Pritom se izduljuje i kada se sila među molekulama vode više ne može opirati sili teži, ona pada.
Sile kojima molekule u tekućinama i čvrstim tvarima međusobno djeluju nazivaju se međumolekularne sile. Te su sile nastale kao posljedica električnog međudjelovanja čestica od kojih su sastavljene molekule.
Čestice od kojih su sastavljene molekule imaju električni naboj, a među nabojima se javljaju sile. Privlačne sile između molekula nastaju između negativnih elektrona i pozitivno nabijene jezgre.
(Međudjelovanja električnih naboja detaljno su obrađena u 3. modulu: Električni naboji i električna sila.)
Međumolekularne sile uglavnom su privlačnog karaktera. S povećanjem razmaka među molekulama, te sile slabe. Na međusobnoj udaljenosti molekula većoj od
te sile su toliko male da se mogu zanemariti.
Međumolekularne sile kod čvrstih tijela jače su nego kod tekućina i zato čvrsta tijela zadržavaju oblik, za razliku od tekućina.
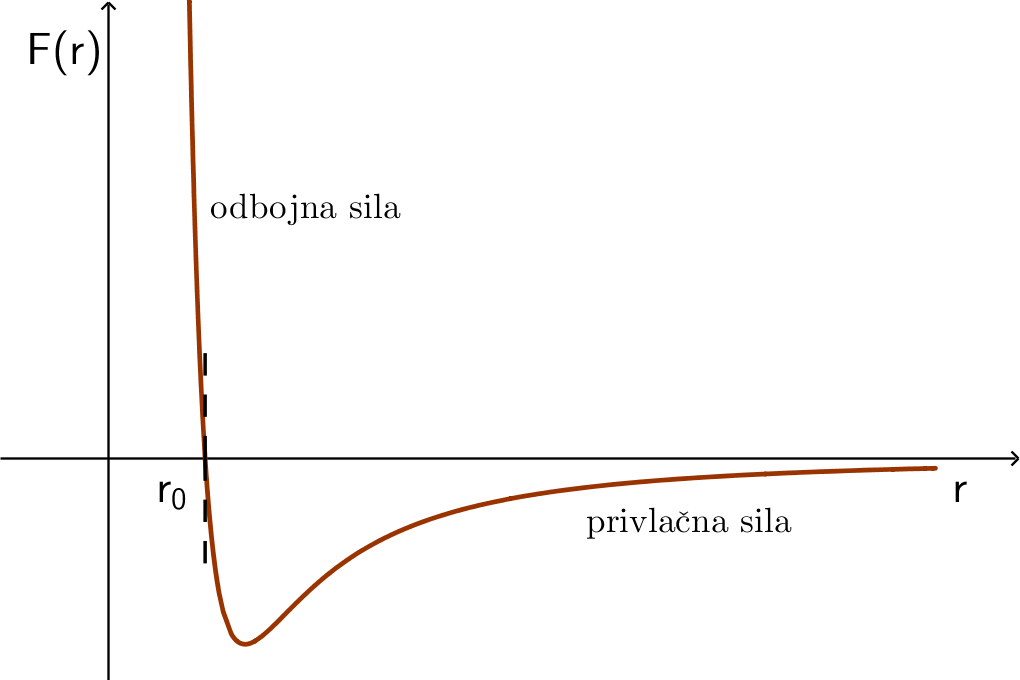
Kada se molekule nalaze u svojim ravnotežnim položajima, ukupno djelovanje na njih iznosi nula. Taj je položaj u dijagramu prikazan točkom
Kao što je vidljivo iz dijagrama, odbojna sila između molekula djeluje na jako malim udaljenostima i to pri međusobnom približavanju molekula. Sila među molekulama blizu ravnotežnog položaja je slaba, pri manjim udaljenostima veća, a s povećanjem udaljenosti sve više slabi. Privlačna sila među molekulama neće potpuno nestati, ali na udaljenostima većima od privlačne sile imaju zanemarive iznose.
U zatvorenoj čvrstoj boci od materijala koji ne vodi toplinu nalazi se plin gustoće
Brzina molekula plina iznosi
Koliki je tlak toga plina?
bara
Plin volumena sadržava čestica pod tlakom od Čestice se gibaju srednjom kinetičkom brzinom Kolika je masa čestica plina ako udaraju u stijenke posude pod kutom od
U ovoj jedinici upoznali smo se sa svojstvima karakterističnim za čvrsta tijela, tekućine i plinove. Kaotično gibanje molekula naziva se i Brownovo gibanje. Shvaćanje molekularne strukture tvari vrlo je važno za razumijevanje pojava koje se događaju u plinovima.