Nezasićeni ugljikovodici – alkeni
- povezati pojam nezasićenosti s prisutnošću dvostruke veze između ugljikovih atoma u molekuli alkena
- objasniti svojstva, upotrebu i način dobivanja etena.
Uvod
Naše mame i bake znaju da će nezrela zelena rajčica prije dozreti ako se između njih postavi jedna zrela rajčica. Isto vrijedi i za jabuke i drugo voće. O čemu je tu riječ?
Zreli plodovi otpuštaju male količine etena koji djeluje na nezrele plodove tako što pospješuje njihovo sazrijevanje. Uz to eten utječe na cvjetanje biljaka kao i na klijanje sjemenki.
Nezasićeni ugljikovodici – alkeni
Ugljikovi atomi međusobno mogu ostvarivati jednostruke, dvostruke i trostruke veze.
Zasićeni alkani – sve veze između ugljikovih atoma su jednostruke.
Nezasićeni ugljikovodici – spojevi s barem jednom dvostrukom ili trostrukom vezom između ugljikovih atoma.
Ugljikovodici s jednom ili više dvostrukih veza u građi svoje molekule jesu alkeni.
Najmanji alken, prvi član u homolognom nizu alkena, sastavljen je od dvaju atoma ugljika.
Opća molekulska formula alkena glasi:
.
pri čemu je “n” oznaka za broj atoma ugljika u molekuli.
Položaj dvostruke veze u molekuli važan je jer utječe na svojstva ugljikovodika i ukazuje na to da je riječ o različitim spojevima.
| redni broj u homolognom nizu | ime ugljikovodika | molekulska formula |
|---|---|---|
| 1. | ETEN | |
| 2. | PROPEN | |
| 3. | BUTEN | |
| 4. | PENTEN | |
| 5. | HEKSEN | |
| 6. | HEPTEN | |
| 7. | OKTEN | |
| 8. | NONEN | |
| 9. | DEKEN |
[/overflower]
Alkene također prikazujemo molekulskom, strukturnom i sažetom strukturnom formulom. Položaj dvostruke veze u molekuli ističe se u imenu što manjim brojem, a dvostruka veza mora biti u sastavu najduljeg lanca ugljika.
| ime alkena | pent-1-en | pent-2-en |
|---|---|---|
| molekulska formula | ||
| sažeta strukturna formula | CH2 = CH – CH2 – CH2 – CH3 | CH3 – CH = CH – CH2 – CH3 |
| model molekule sastavljen od kuglica i štapića | 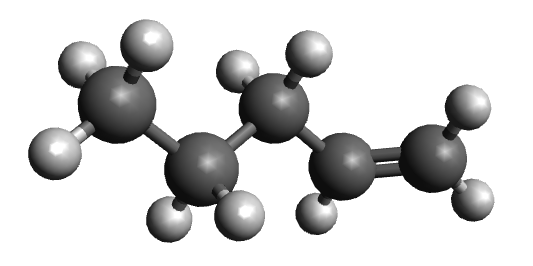 |
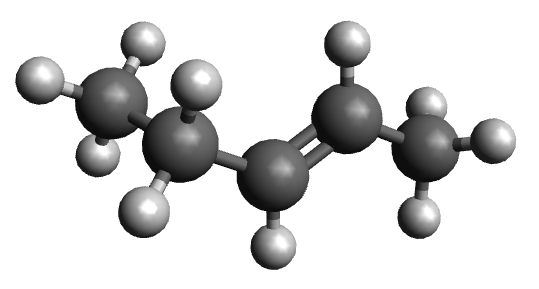 |
Nezasićeni ugljikovodici – alkeni
Ugljikovi atomi međusobno mogu ostvarivati jednostruke, dvostruke i trostruke veze. Ako su između ugljikovih atoma sve veze jednostruke, spojevi će pripadati zasićenim alkanima. Spojevi s barem jednom dvostrukom ili trostrukom vezom između ugljikovih atoma pripadaju nezasićenim ugljikovodicima.
Ugljikovodici s jednom ili više dvostrukih veza u građi svoje molekule jesu alkeni. Najmanji alken, prvi član u homolognom nizu alkena, sastavljen je od dvaju atoma ugljika. Opća molekulska formula alkena glasi:
.
pri čemu je “n” oznaka za broj atoma ugljika u molekuli.
Sljedeća tablica prikazuje članove homolognog niza jednostavnih alkena, spojeva koji imaju samo jednu dvostruku vezu u molekuli. Zajednički nastavak u imenu svih alkena jest -EN.
| redni broj u homolognom nizu | ime ugljikovodika | molekulska formula |
|---|---|---|
| 1. | ETEN | |
| 2. | PROPEN | |
| 3. | BUTEN | |
| 4. | PENTEN | |
| 5. | HEKSEN | |
| 6. | HEPTEN | |
| 7. | OKTEN | |
| 8. | NONEN | |
| 9. | DEKEN |
Alkene također prikazujemo molekulskom, strukturnom i sažetom strukturnom formulom. Položaj dvostruke veze u molekuli ističe se u imenu što manjim brojem, a dvostruka veza mora biti u sastavu najduljeg lanca ugljika.
| ime alkena | pent-1-en | pent-2-en |
|---|---|---|
| molekulska formula | ||
| sažeta strukturna formula | CH2 = CH – CH2 – CH2 – CH3 | CH3 – CH = CH – CH2 – CH3 |
| model molekule sastavljen od kuglica i štapića |  |
 |
Pri crtanju dvostruke veze u molekuli s više od triju ugljikovih atoma opaža se mogućnost pojave strukturnih izomera. Osim mogućnosti različitih položaja nezasićene dvostruke veze, u molekuli može biti i različit raspored ugljikovih atoma u lancu. Položaj dvostruke veze u molekuli važan je jer utječe na svojstva ugljikovodika. Tako će dva ugljikovodika istog broja atoma ugljika i vodika, ali s različitim položajem dvostruke veze, imati različita svojstva.
Osim lančanih alkena također postoje i prstenasti nezasićeni spojevi, cikloalkeni.
Istaknimo da lančani i prstenasti spojevi ugljikovodika nisu međusobno strukturni izomeri jer nemaju jednak broj atoma ugljika i vodika u svojoj strukturi.
| ime alkena | but-1-en | ciklobuten |
|---|---|---|
| molekulska formula |
||
| model molekule sastavljen od kuglica i štapića |
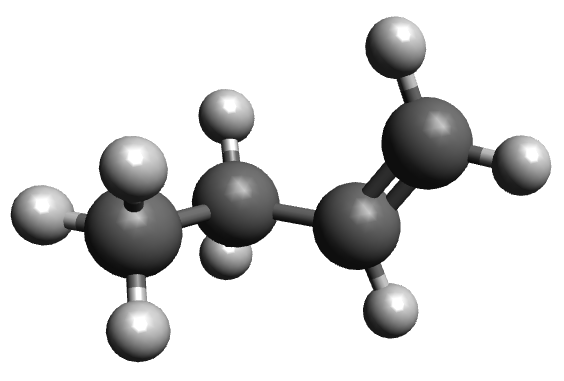 |
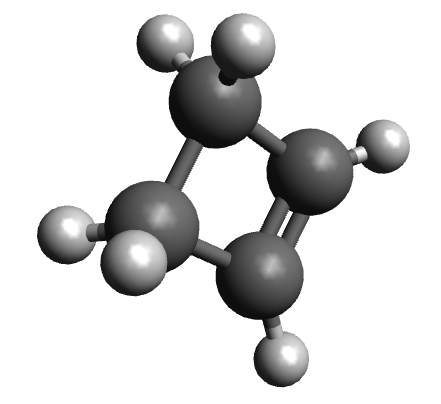 |
Opazit ćete podudarnost u općim molekulskim formulama alkena i cikloalkana. One su jednake i glase: . Za razliku od opće molekulske formule alkana (), ovoj nedostaju dva atoma vodika. Zato se ne može reći je li riječ o alkenu ili cikloalkanu ako je poznata samo molekulska formula spoja. Primjerice, molekulska formula odgovara butenu i ciklobutanu. Međutim, nedoumice nema ako se koristi strukturna formula.
Karakteristične kemijske reakcije alkena
Alkeni su reaktivniji od alkana, a dvostruka veza u molekuli je reaktivno mjesto.
Osim već poznate reakcije gorenja (oksidacije) alkena, za ovu skupinu važna je kemijska reakcija adicije.
Adicija je kemijska reakcija dodavanja atoma na ugljikove atome koji ostvaruju dvostruku vezu.
Pri tome dvostruka veza puca i postaje jednostruka veza, što znači da nastaje zasićeni ugljikovodik.
Primjer: reakcija adicije vodika na molekulu etena.
Adicijom vodika na nezasićeni eten nastaje zasićeni etan – dvostruka je veza pukla i postala jednostruka.
Karakteristične kemijske reakcije alkena
Poput zasićenih ugljikovodika, alkana, i nezasićeni su ugljikovodici zapaljivi te pri gorenju oslobađaju veliku količinu topline. Gorenjem alkena uz dovoljnu količinu kisika nastaju produkti ugljikov(IV) oksid i voda. U reakciji gorenja alkena uz nedovoljnu količinu kisika nastaju ugljikov(II) oksid i voda. Primjer gorenja etena uz dovoljnu količinu kisika možemo prikazati sljedećom jednadžbom kemijske reakcije:
.
Napišite jednadžbu kemijske reakcije gorenja etena uz nedovoljnu količinu kisika. Pri tome možete koristiti alat Pisanje kemijskih jednadžbi na webu.
Alkeni su reaktivniji od alkana, a dvostruka veza u molekuli reaktivno je mjesto. Osim već poznate reakcije gorenja (oksidacije) alkena, za ovu skupinu važna je kemijska reakcija adicije.
Adicija je kemijska reakcija dodavanja atoma na ugljikove atome koji ostvaruju dvostruku vezu. Pri tome dvostruka veza između atoma ugljika puca i postaje jednostruka veza. Radi lakšeg uočavanja adicije, jednadžbe kemijskih reakcija najčešće se pišu sažetim strukturnim formulama.
Primjer: reakcija adicije vodika na molekulu etena.
Adicijom vodika na nezasićeni eten nastaje zasićeni etan.
Kako možemo utvrditi nezasićenost ugljikovodika?
Nezasićene ugljikovodike od zasićenih možemo razlikovati izvođenjem testne reakcije.
Pri tome se koriste reagensi bromna voda ili vodena otopina kalijeva permanganata.
Reagensi imaju karakterističnu boju, a u dodiru s nezasićenim ugljikovodikom ta boja nestaje.
Bromna voda je žute boje, no ta boja tijekom reakcije nestaje jer se brom adira (veže) na ugljikove atome.
Kako možemo utvrditi nezasićenost ugljikovodika?
Nezasićene ugljikovodike od zasićenih možemo razlikovati izvođenjem testne reakcije. Pri tome se koriste karakteristični testni reagensi: bromna voda ili vodena otopina kalijeva permanganata. Reagensi imaju karakterističnu boju, a u dodiru s nezasićenim ugljikovodikom boja reakcijske smjese mijenja se u bezbojnu.
Bromna je voda žute boje, no ona boja tijekom reakcije nestaje jer se bromidni ioni adiraju (vežu) na ugljikove atome koji ostvaruju nezasićenu vezu u molekuli alkena. Pri tome nastaju zasićeni halogenalkani.
Vodena otopina kalijeva permanganata je purpurne boje, no ona se tijekom testne reakcije mijenja – ili se izgubi ili se pojavi smeđa boja.
Znači, bilo koja promjena purpurne boje pozitivan je rezultat, odnosno dokaz da je riječ o nezasićenom ugljikovodiku.
Eten – svojstva, upotreba i dobivanje
Alkeni su važni organski spojevi jer su mnogi od njih polazne tvari (sirovine) za proizvodnju umjetnih polimera, lijekova, boja i ostalih organskih spojeva. Među njima važno mjesto zauzima eten.
Eten je bezbojan i slatkast plin, karakteristična mirisa.
Vrlo je reaktivan, može se zapaliti, a pomiješan sa zrakom stvara eksplozivnu smjesu.
Talište etena je pri –169 oC, vrelište mu je pri –103,7 oC.
Dobivanje etena u laboratoriju
- U manjim količinama, i u uvjetima školskog laboratorija, eten se može dobiti zagrijavanjem etanola uz prisutnost sumporne kiseline i pijeska. U tom procesu sumporna kiselina služi kao dehidratacijsko sredstvo, a pijesak kao katalizator.
Vodena otopina kalijeva permanganata purpurne je boje, no ona se tijekom testne reakcije mijenja. Uz potpunu redukciju permanganatnog iona do iona, reakcijska smjesa postat će bezbojna, a uz nepotpunu redukciju do , postat će smeđe boje. Dakle, pozitivan rezultat na testni reagens jest promjena purpurne boje reakcijske smjese.
Eten – svojstva, upotreba i dobivanje
Alkeni su važni organski spojevi jer su mnogi od njih polazne tvari (sirovine) za proizvodnju umjetnih polimera, lijekova, boja i ostalih organskih spojeva. Među njima važno mjesto zauzima eten.
Eten je bezbojan i slatkast plin, svojstvena mirisa. Vrlo je reaktivan, može se zapaliti, a pomiješan sa zrakom stvara eksplozivnu smjesu. Talište etena jest pri –169 °C, vrelište je pri –103,7 °C, a gustoća mu iznosi 1,178 kg/m3 pri 15 °C. Kod iste temperature gustoća zraka nešto je veća i iznosi 1,2250 kg/m3 .
Dobivanje etena u laboratoriju
- U manjim količinama, i u uvjetima školskog laboratorija, eten se može dobiti zagrijavanjem etanola uz prisutnost sumporne kiseline i pijeska. U tom procesu sumporna kiselina služi kao dehidratacijsko sredstvo, a pijesak kao katalizator.
Industrijsko dobivanje etena
- U većim količinama eten se proizvodi krekiranjem (cijepanjem) većih molekula ugljikovodika iz sastava nafte. Osim toga može se proizvesti reakcijom adicije vodika na etin.
Upotreba etena
- Eten je vrlo reaktivan i zbog tog svojstva izvrsna je sirovina za proizvodnju drugih organskih spojeva, poput alkohola ili umjetnih polimera.

Broj nezasićenih ugljikovodika alkena uistinu je vrlo velik. Među njima istaknimo zanimljivu skupinu u čijoj se molekuli jednostruke i dvostruke veze pravilno izmjenjuju.
Organski kemičari takve veze nazivaju konjugirane dvostruke veze. Takvoj skupini alkena pripada β-karoten, tvar odgovorna za boju mrkve. β-karoten izoliran je iz mrkve 1830. godine i prema tome je dobio ime (grč. karota – mrkva). Biokemijskim reakcijama u tijelu ljudi β-karoten prelazi u vitamin A.
Karoteni nisu samo pigmenti u biljnom carstvu nego se nalaze i u carstvu životinja. U posebnoj vezi karotena i bjelančevina nastaju pigmenti koji stvaraju prekrasne boje koralja, riba, rakova i drugih morskih organizama.
Istražite u literaturi i na stručnim mrežnim stranicama strukturnu formulu β-karotena. Što uočavate?
Potom istražite skupinu karotena i važnost tih tvari za zdravlje. Pokušajte saznati njihovu ulogu u fotosintezi.
U radu neka vam pomognu prijatelji iz razreda, a rezultate prikažite na plakatu i izvjesite ga u školi. Sretno!
Na kraju…
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Ime ugljikovodika alkena sažete strukturne formule jest:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji alken ubrzava dozrijevanje voća?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Zaokružite dvije točne tvrdnje.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja je tvar odgovorna za boju mrkve?
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Ime ugljikovodika alkena sažete strukturne formule
jest:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji alken ubrzava dozrijevanje voća?
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Prosječna je molekulska masa zraka 29, ( ).
Izračunajte relativnu molekulsku masu za eten i usporedite rezultat s vrijednošću relativne molekulske mase zraka.
Na temelju dobivenih rezultata, odgovorite je li sljedeća tvrdnja točna ili netočna.
Eten ima veću gustoću od zraka.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja je tvar reaktant u laboratorijskom procesu dobivanja etena?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji zasićeni spoj nastaje reakcijom propena i broma?
Želite li pokušati ponovo?



