Građa atoma
- definirati subatomske čestice: proton, neutron i elektron
- opisati građu atoma
- ispričati povijesni razvoj ideje o postojanju atoma
- odrediti protonski i nukleonski broj
- povezati atomski i nukleonski broj s brojem protona, neutrona i elektrona
- obrazložiti zašto se nukleonski broj naziva i masenim brojem
- obrazložiti tvrdnju da je atom neutralna čestica.
Uvod
Grčki su filozofi prije 2500 godina raspravljali o tome kako se tvari mogu usitnjavati do najmanjih dijelova.
Leukip i Demokrit, koji su živjeli u 5. stoljeću prije Krista, mislili su da se usitnjavanjem tvari dobiju čestice
koje se više ne mogu dijeliti.
Te čestice Demokrit je nazavao atomima (grčki atomos znači nedjeljiv).
Njihovo učenje nije bilo prihvaćeno i stoljećima je bilo zaboravljeno.
Uvod
Još prije 2500 godina grčki su filozofi materijalisti raspravljali o tome do koje se granice tvari mogu usitnjavati. Tako su Leukip i
koji su živjeli u 5. stoljeću prije Krista, pretpostavili da bi usitnjavanjem tvari na najmanje dijelove dobili čestice tvari koje se više ne bi mogle dijeliti. Te je čestice Demokrit nazvao atomima (grčki atomos znači nedjeljiv). Njihovo je učenje nailazilo na veliki otpor i neprihvaćanje te je stoljećima bilo zaboravljeno.
John Dalton (1766. – 1844.) bio je svjetski poznat engleski kemičar.
Prvi je pokusom utvrdio da su tvari građene od malenih čestica.
On je početkom 19. stoljeća obnovio atomističku teoriju grčkih filozofa.
S dvanaest godina osnovao je svoju školu u kojoj je vršnjake podučavao sve predmete.
Opisao je atome kao nevidljive i nedjeljive kuglice.
Dalton i njegov brat nisu razlikovali boje.
Prema njima taj se nedostatak naziva daltonizam.
Prvi znanstvenik koji je na temelju eksperimentalnog rada zaključio da su tvari građene od malenih čestica atoma bio je engleski kemičar
U prirodi je poznato 90 vrsta atoma od kojih su građene tvari.
Bezbroj različitih tvari može se sastaviti kombiniranjem samo 90 atoma.
Atomi su tako male čestice da bi na duljinu 1 mm stala čak 2 000 000 atoma željeza.
Atome često prikazujemo modelima kao male kuglice ili kalote.
Važno je naglasiti da atomi nemaju čvrste i oštre granice.
Danas postoje posebni uređaji kojima dobivamo vrlo uvećanu sliku atoma.
Takvim se uređajima vidi da tvari imaju zrnatu strukturu i da su sastavljene od atoma.
U prirodi je poznato 90 vrsta atoma od kojih su građene tvari. Kombiniranjem samo 90 atoma moguće je sastaviti nebrojeno mnogo različitih tvari.
Atomi su tako male čestice da bi na duljinu 1 mm stala čak 2 000 000 atoma željeza. Iako modele atome često prikazujemo kao kuglice ili kalote, važno je naglasiti da atomi nemaju čvrste i oštre granice.
Danas postoje posebni uređaji kojima dobivamo vrlo uvećanu sliku. Takvim se uređajima vidi da tvari imaju zrnatu strukturu i da su sastavljene od atoma.
No jesu li atomi zaista najmanje čestice?
Razvojem fizike krajem 19. i početkom 20. stoljeća
otkriveno je da su atomi građeni od još sitnijih čestica.
Njih nazivamo subatomske čestice.
Najznačajniji od njih su protoni, neutroni i elektroni.
Protoni i elektroni imaju naboj.
Proton ima najmanji pozitivni naboj.
Elektron najmanji negativni naboj.
Taj se iznos naboja naziva elementarni naboj.
Neutroni su neutralne čestice bez naboja.
Protone se označava p ili p+, neutrone n ili n0, a elektrone e ili e–.
Masa protona i neutrona približno je jednaka.
Masa elektrona je oko 2000 puta manja od mase protona.
Oznake protona, neutrona i elektrona te njihova svojstva navedena su u tablici.
| NAZIV | OZNAKA | NABOJ | MASA |
|---|---|---|---|
| proton | p ili p+ | +, pozitivan | m(p+) ≈ m(n0) |
| neutron | n ili n0 | 0, neutralan (nema naboj) | (n0) ≈ m(p+) |
| elektron | e ili e– | –, negativan | m(e-) ≈ m(p+)/2000m |
No jesu li atomi zaista najmanje čestice?
Razvojem fizike krajem 19. i početkom 20. stoljeća otkriveno je da su atomi građeni od još sitnijih čestica. To su protoni, neutroni i elektroni. Nazivamo ih subatomskim česticama. Protoni i elektroni imaju naboj. Proton ima najmanji pozitivni naboj, a elektron najmanji negativni naboj. Taj se iznos naboja naziva elementarni naboj. Neutroni su neutralne čestice, odnosno čestice bez naboja.
Protone se označava ili , neutrone ili , a elektrone ili .
Masa protona i neutrona približno je jednaka, a masa elektrona oko 2000 puta manja je od mase protona.
Oznake protona, neutrona i elektrona te njihova svojstva navedena su u tablici.
| naziv | oznaka | naboj | masa |
|---|---|---|---|
| proton | ili | pozitivan
(+)
|
|
| neutron | ili | neutralan (nema naboj)
(0) |
|
| elektron | ili | negativan
(–) |
Elektron je grčka riječ za jantar.
Jantar je skrućena smola četinjača.
Protrljamo li jantarni štap svilenom krpom,
štap i krpa se privlače zbog različitih električnih naboja.
Tu su pojavu otkrili još stari Grci.
Fizičari su pokusima dokazali da postoje samo dvije vrste naboja.
Dogovorili su se da se negativnim električnim nabojem naziva naboj
jednak onome koji nastaje trljanjem jantarnog štapa.
Pozitivan električni naboj jest naboj jednak onome
koji nastaje trljanjem svilene krpe.
Sila koja djeluje između električnih naboja naziva se električna sila.
Ta je sila između suprotnih električnih naboja privlačna,
a između jednakih električnih naboja odbojna.

Elektron – jantar
Elektron je grčka riječ za jantar. Jantar je skrućena smola četinjača. Protrljamo li jantarni štap svilenom krpom, štap i krpa se privlače jer na njima nastaju različiti električni naboji. Tu su pojavu otkrili još stari Grci.
Fizičari su pokusima dokazali da postoje samo dvije vrste naboja. Dogovorili su se da se negativnim električnim nabojem naziva naboj jednak električnom naboju koji nastaje trljanjem jantarnog štapa. Pozitivan električni naboj stoga je naboj jednake vrste kao onaj koji nastaje trljanjem svilene krpe.
Sila koja djeluje između električnih naboja naziva se električna sila. Ta je sila između suprotnih električnih naboja privlačna, a između jednakih električnih naboja odbojna.
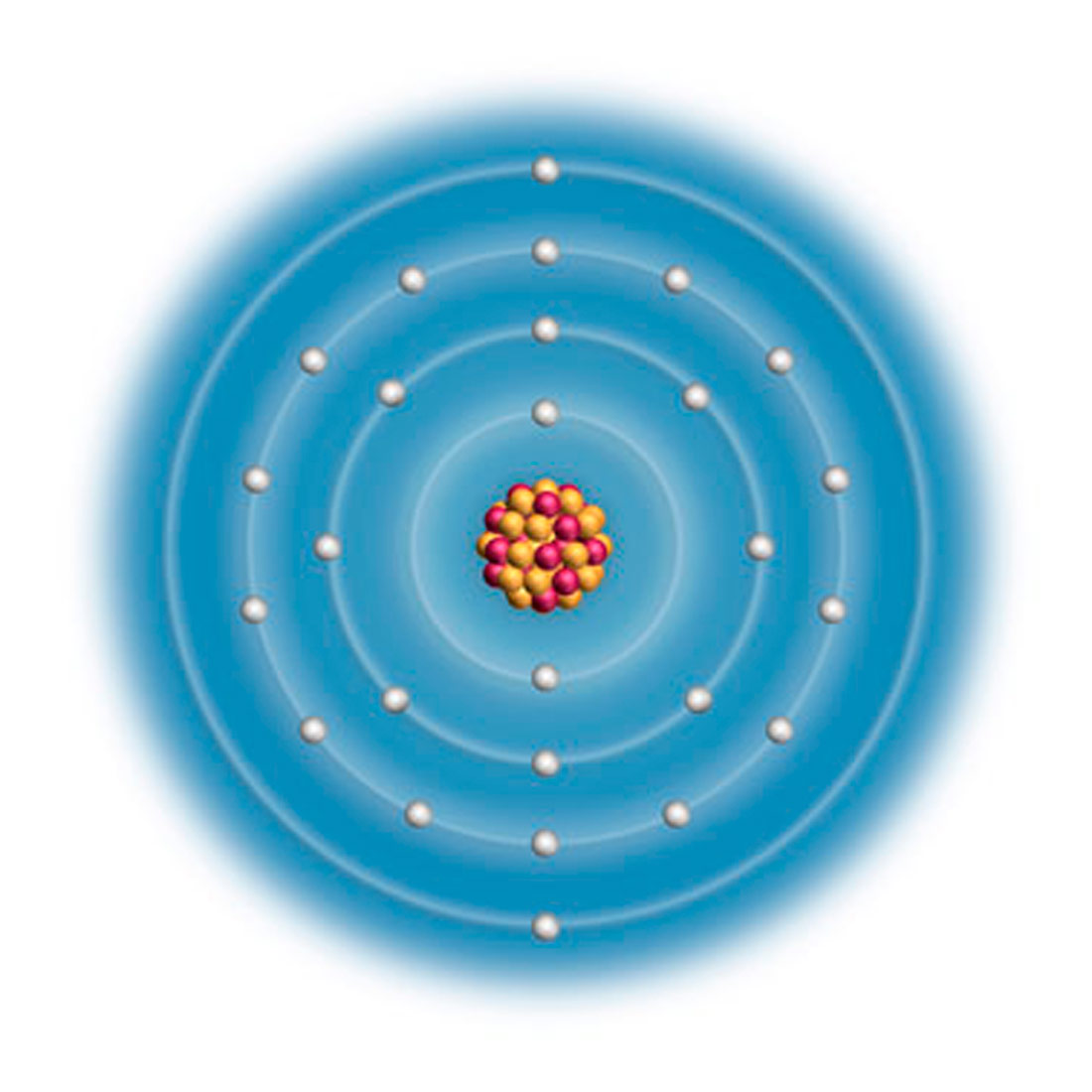
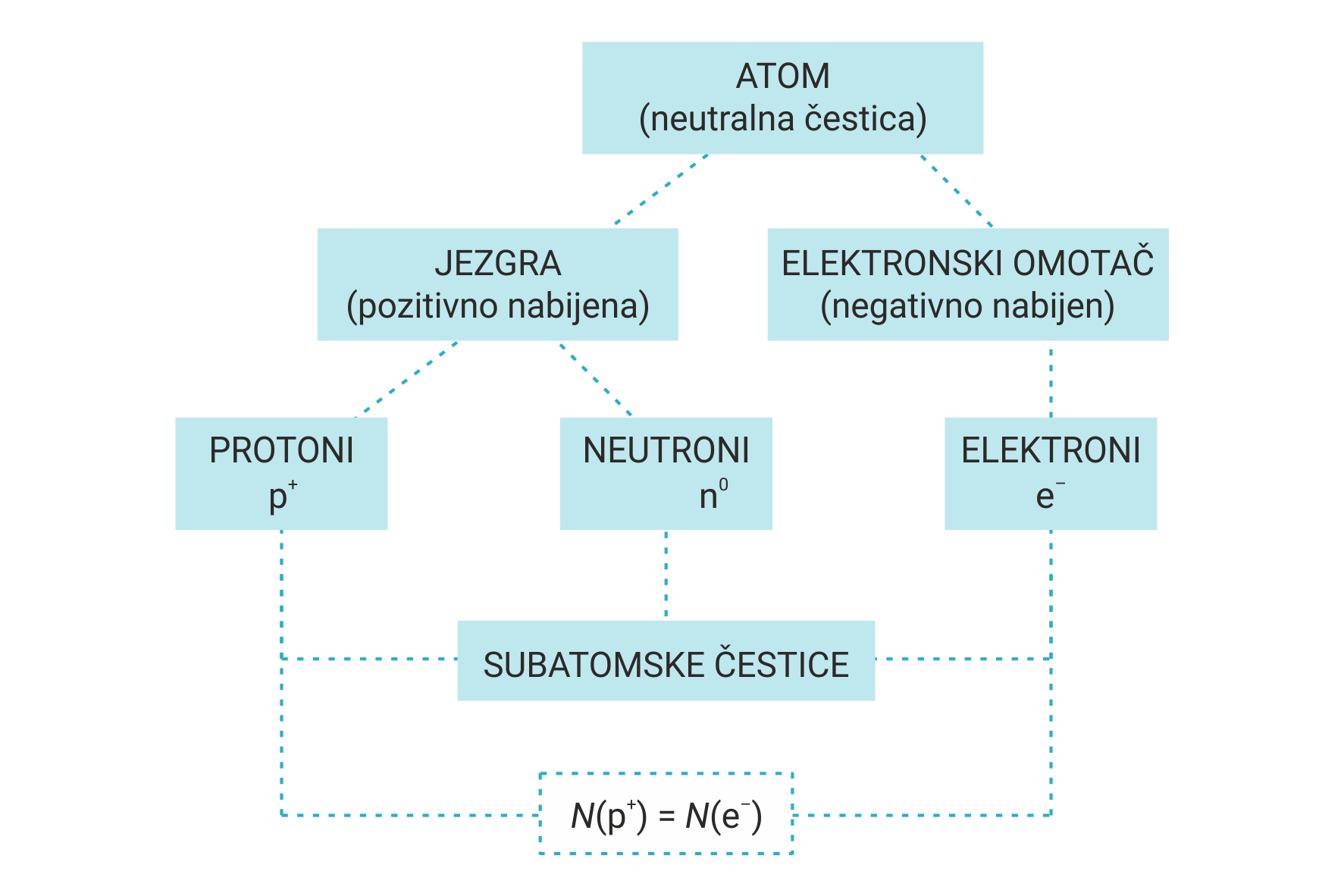
Svaki atom ima svoju unutarnju građu.
U središtu je atoma atomska jezgra (nukleus) građena od protona i neutrona.
Zbog naboja protona atomska je jezgra pozitivno nabijena.
Prostor oko atomske jezgre zove se elektronski omotač ili elektronski oblak.
U njemu se na određenoj udaljenosti od jezgre nalaze elektroni.
Zbog naboja elektrona elektronski je omotač negativno nabijen.
Jezgra zauzima vrlo malen prostor atoma.
Promjer jezgere je oko 10 000 puta manji od promjera atoma
U njoj je smještena gotova cijela njegova masa.
Svaki atom ima svoju unutarnju građu. U središtu je atoma atomska jezgra (nukleus) građena od protona i neutrona. Zbog naboja protona atomska je jezgra pozitivno nabijena.
Prostor oko atomske jezgre zove se elektronski omotač ili elektronski oblak. U njemu se na određenoj udaljenosti od jezgre nalaze elektroni. Zbog naboja elektrona elektronski je omotač negativno nabijen.
Jezgra zauzima vrlo malen prostor atoma. Njezin je promjer oko 10 000 puta manji od promjera atoma i u njoj je smještena gotova cijela njegova masa.
Svaki atom ima svoju unutarnju građu.
U središtu atoma je atomska jezgra (nukleus).
Jezgra je građena od protona i neutrona.
Atomska jezgra je pozitivno nabijena zbog naboja protona.
Elektronski omotač je prostor oko atomske jezgre.
U njemu se nalaze elektroni.
Položaj elektrona u omotaču ne može se točno utvrditi.
Elektronski omotač je negativno nabijen zbog naboja elektrona.
Jezgra zauzima vrlo malen prostor atoma.
Promjer jezgre je oko 10 000 puta manji od promjera atoma.
Elektroni su jako mali.
Možemo zaključiti da je atom najvećim dijelom prazan prostor.
Elektroni su u elektronskom omotaču raspoređeni određenim redom. Veličinu atoma određuje veličina elektronskog omotača.
Atom pojedinog elementa ima jednak broj protona i elektrona pa je u cjelini neutralan.
Iz toga zaključujemo da je atom neutralan i stabilan sustav pozitivno nabijene jezgre i negativno nabijenih elektrona koji grade elektronski omotač.
Protonski broj pokazuje koliko protona ili elektrona ima neki atom.
Označava se velikim slovom Z.
Slovom označavamo ukupan broj čestica iste vrste (od latinskog numerus što znači broj).
Svi atomi iste vrste imaju jednak protonski broj.
Primjerice, svi atomi sa šest protona i šest elektrona jesu atomi ugljika.
Nukleonski broj je zbroj protona i neutrona.
Koristi se za opisivanje vrste atoma.
Označava se velikim slovom A.
Nukleonski broj = broj protona + broj neutrona
Broj neutrona jednak je razlici nukleonskog i protonskog broja.
Broj koji pokazuje od koliko je protona, odnosno elektrona građen neki atom, zove se protonski broj. Označava se velikim slovom Z.
Slovom N označavamo ukupan broj jedinki odnosno čestica (od latinskog numerus što znači broj).
Svi atomi iste vrste imaju jednak protonski broj. Primjerice, svi atomi sa šest protona i šest elektrona jesu atomi ugljika.
Zbroj protona i neutrona u jezgri atoma naziva se nukleonskim brojem. On se koristi za potpuno opisivanje vrste atoma. Označava se velikim slovom A.
Broj neutrona jednak je razlici nukleonskog i protonskog broja.
Riješeni primjer
Protonski broj željeza jest 26.
Nukleonski mu je broj 56.
Izračunajte koliko jedan atom željeza ima protona, elektrona i neutrona.
Zadano je:
Traži se:
Izračun:
Odgovor:
Opisani atom željeza ima 26 protona, 26 elektrona i 30 neutrona.
Na kraju…
Proučite shematski prikaz i odgovorite na pitanja koja slijede!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koje čestice nemaju naboj?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kojim slovom označavamo protonski broj?
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
U zadatku označite dvije točne tvrdnje.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U atomu kalija 19 je elektrona u omotaču, a 20 neutrona u jezgri. Koji je nukleonski broj kalija?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Protonski je broj atoma fluora 9, a nukleonski broj 19. Koja od navedenih tvrdnji opisuje građu atoma fluora?
Želite li pokušati ponovo?