Metali, oksidi metala i baze
- opisati fizikalna i kemijska svojstva metala
- opisati razliku između hidroksida metala i lužine
- izmjeriti pH-vrijednost lužnatih otopina univerzalnim indikatorom te objasniti dobiveni rezultat
- jednadžbom kemijske reakcije prikazati reakcije kalcija i magnezija s kisikom i reakcije kalcijevog oksida i magnezijevog oksida s vodom
- jednadžbom kemijske reakcije prikazati nastajanje špiljskih ukrasa, reakciju vezanja žbuke i reakciju taloženja i otapanja "kamenca"
- protumačiti proces korozije željeza te načine zaštite željeza od korozije.
Uvod
U sedmom razredu upoznali ste alkalijske metale pri kraju nastavne godine. Prisjetimo se nekih njihovih svojstava.
Metali koje možemo rezati nožem!
Istražite kako se na siguran način čuvaju cezij i francij.
Manje količine cezija i francija čuvaju se u vakuumskim ampulama od borosilikatnog stakla ili u atmosferi inertnog plina (dušik, argon).
Navedite neke kemijske spojeve alkalijskih metala.
Neki od njih važni su u današnjoj industrijskoj proizvodnji, a drugi se koriste još od vremena drevnih civilizacija. To su: natrijev klorid, kalijev klorid, natrijev hidroksid, natrijev karbonat, natrijev hidrogenkarbonat, natrijev nitrat, kalijev nitrat i kalijev karbonat.
Čilska salitra, natrijev nitrat, , tvar je dobro topljiva u vodi. U prirodi postoji kao mineral u Zemljinoj kori samo na onim mjestima gdje su atmosferske oborine u potpunosti izostale. Takva su pustinjska područja u Čileu. Riječ salitra dolazi iz srednjovjekovnog latinskog “sal nitrum”. Značenje riječi “nitrum” mijenjalo se u starom i srednjem vijeku, a vuče podrijetlo od imena egipatske provincije Nitria. Više o tome saznajte u knjizi History of inventions, discoveries and origins, John Beckmann, London, 1846.
Potaša, kalijev karbonat, , ime duguje engleskoj riječi “potash” koja označava svaku sol (mineralnu ili proizvedenu) koja sadrži kalij i topljiva je u vodi. Potash (pot = lonac + ash = pepeo) odnosi se na pepeo dobiven spaljivanjem biljke namočene u vodi. Tako su se dobivale kalijeve soli prije industrijske ere.
Svojstva metala
Svojstva metala
Istražite na stručnim mrežnim stranicama ili u stručnoj literaturi koje metale možemo naći u pametnim telefonima i čemu služe. Razmislite o važnosti recikliranja takvih uređaja.
Tantal – koristi se za pohranu električne energije u bateriji.
Bakar – koristi se u tranzistorima za pojačavanje te moduliranje signala.
Zlato – koristi se u žičanim prevlakama.
Kositar – koristi se pri lemljenju komponenata na pločaste sklopove.
Volfram – sastavni je dio komponente koja omogućuje vibriranje telefona.
Metali su većinom reaktivni i u prirodi se nalaze u obliku spojeva. Svojstva metala upoznat ćete pobliže na primjeru kalcija i željeza.
Kalcij
Kalcij je reaktivni metal srebrnobijele boje.
Kada je izložen zraku, kalcij na površini stvara tamni zaštitni sloj.
Kalcij se može zapaliti i pri tome gori žutocrvenim plamenom.
Kemijska jednadžba gorenja kalcija:
.
Metali su većinom reaktivni i u prirodi se nalaze u obliku spojeva. Svojstva metala upoznat ćete pobliže na primjeru kalcija i željeza.
Kalcij
Kalcij je reaktivni metal srebrnobijele boje i nalazi se u drugoj skupini periodnog sustava elemenata. To je jedan od zemnoalkalijskih metala. Kada je izložen zraku, kalcij na površini stvara tamni zaštitni sloj kalcijevog oksida i kalcijevog nitrida. Kalcij se može zapaliti i pri tome gori žutocrvenim plamenom. Kemijska jednadžba gorenja kalcija:
.
Istražite zašto je kalcij biogeni element – elementarna tvar čiji spojevi sudjeluju u izgradnji živih bića.
Kalcij je važan biogeni element. Najvećim dijelom kalcijevi ioni nalazi se u sastavu kostiju i zubi. Sudjeluju u mišićnoj i živčanoj podražljivosti kao i kod procesa zgrušavanja krvi.
Osim biološkog značenja, važna je i primjena kalcija u tehnologiji. Kalcijem tretirani čelici koriste se u proizvodnji dijelova automobila, aviona i raznih ventila, cijevi i alata za bušenje.
Željezo
Kada kažemo metal, najčešće svi pomislimo na željezo. Željezo je poznato od davnina i danas je metal s najvećom primjenom. Prednost željeza pred drugim metalima leži u jednostavnu načinu proizvodnje i lakoj dostupnosti njegovih ruda.
Najpoznatije rude željeza
Željezo je sivobijeli metal.
Vrlo je reaktivan. Na zraku je nestabilan i brzo oksidira pa nastaje hrđa.
Hrđanje će se ubrzati ako se željezo izloži slanoj vodi, a usporit će se ako nema dovoljno vode ili kisika.
Proces nagrizanja metala koji dovodi do hrđe nazivamo korozija.
Korozija može načiniti veliku štetu (npr. na mostovima načinjenim od željeza) pa su ljudi pronašli mnoge načine zaštite od korozije:
1) nanošenje nemetalne prevlake (plastificiranje, premazivanje uljanim bojama) ili nanošenje metalne prevlake (od cinka – pocinčavanje, od zlata – pozlaćivanje)
2) promjenom uvjeta u kojima se predmet nalazi.
Željezo je sivobijeli metal, vrlo je reaktivan, na zraku je nestabilan i brzo oksidira – hrđa. Željezo hrđa u prisutnosti vode i kisika. Proces hrđanja ubrzat će se ako se željezo izloži slanoj vodi ili je u dodiru s bakrom, a usporava se pri nedostatnoj količini vode ili kisika. Zbog vrlo velikih ekonomskih šteta izazvanih korozijom, razvijene su mnogobrojne metode zaštite od korozije. To su:
1) metode nanošenja prevlake koja može biti nemetalna (plastificiranje, premazivanje uljanim bojama, emajliranje) ili metalna (galvanizacija – pocinčavanje, poniklavanje, pozlaćivanje)
2) elektrokemijske metode (metal se elektrokemijski održava u pasivnom stanju u dodiru s magnezijem ili cinkom koji će oksidirati umjesto željeza)
3) metode promjene uvjeta u kojima se korozivni predmet nalazi (odnosi se na zaštitu željeza od vlage, primjerice premazivanje željeznog predmeta zaštitnim uljem ili pastom od epoksi-smole, korištenje paketića silicijevoga gela u ormarićima za skladištenje željeznih predmeta).
Proučite sliku i zaključite u kojim će se uvjetima najbrže odvijati hrđanje.
Hrđanje željeza izraženo je na mjestu granice vode i zraka (prva epruveta) – idealni uvjeti hrđanja. Bez prisutnosti vode (druga epruveta) ili zraka (treća epruveta) hrđanje skoro u potpunosti izostaje. Hrđanje željeza jest oksidacijsko-redukcijski proces u kojem dolazi do prijenosa elektrona u nizu reakcija. Zato je hrđanje najbrže u slanoj vodi koja je izvrstan elektrolit.
Biogeni elementi kemijski su elementi koji izgrađuju sva živa bića.
Željezo je važan biogeni element.
U našem tijelu nalazi se u sastavu hemoglobina – crvenog krvnog pigmenta koji služi za prijenos kisika. Ako u tijelu nemamo dovoljnu količinu željezovih iona, nastaje bolest koju nazivamo anemija.
Sirovo je željezo vrlo krhko i nije pogodno za upotrebu pa se najčešće miješa s drugim metalima da bi postalo čvršće.
Taj se postupak naziva legiranje.
Legiranjem nastaje legura ili slitina – smjesa dvaju ili više metala.
Najpoznatija legura željeza jest čelik.
Željezo je važan biogeni element. U organizmu su prisutni željezovi ioni. Nalaze se u sastavu hemoglobina i mioglobina. Nedostatak željezovih iona u organizmu očituje se kao manjak hemoglobina u krvi, što može dovesti do anemije.
Legure ili slitine
Sirovo je željezo krhko i nepogodno za primjenu pa se zato najčešće legira. Najpoznatija legura željeza jest čelik.
Legure su homogene smjese dvaju ili više metala. Legure imaju nova svojstva, drugačija od svojstava pojedinih metala u sastavu legure.
Upoznajmo neke legure!

Proširite svoje znanje o nekim svojstvima i primjeni sljedećih metala: magnezija, bakra, aluminija i kositra.
Magnezij, Mg
Magnezij je srebrnobijeli metal koji na zraku brzo potamni. Za školske potrebe najčešće se koristi u obliku uske vrpce. Mekan je i može se rezati nožem. Pri sobnoj je temperaturi postojan. Može se zapaliti i pri gorenju se oslobađa blještava bijela svjetlost i toplina. Magnezij je također biogeni element. Magnezijevi ioni nalaze se u kostima i zubima, važni su za rad mišića, a nalaze se i u krvi. Sudjeluju u enzimskim reakcijama, u radu živčanog sustava i endokrinih žlijezda. Kod biljaka se nalaze u sastavu molekule klorofila.
Bakar, Cu
Bakar je metal crvenosmeđe boje, mekan je, žilav i rastezljiv, pa se lako mehanički obrađuje u žice i limove. Bakreni vodiči izvrsni su vodiči topline i električne energije. Izložen atmosferi, oborinama ili slanoj vodi, bakar korodira samo površinski, pa ga patina – tanki sloj koji može sadržavati oksid, klorid, sulfat, sulfid i karbonat – štiti od daljnje korozije. Većinom se koristi u elektrotehnici, metalurgiji i građevinarstvu. Najpoznatije legure bakra jesu mjed i bronca.
Aluminij, Al
Aluminij je mekani metal srebrnobijele boje. Lagan je i krt, dobar je vodič topline i električne energije. Na svojoj površini aluminij stvara zaštitni oksidni sloj pa je postojan na zraku i u dodiru s vodom. Aluminij se koristi u proizvodnji industrijske ambalaže, u građevinarstvu, elektrotehnici i metalurgiji. Neke su od aluminijskih legura duraluminij, magnalij, silumin i alnico.
Kositar, Sn
Kositar je mekan i sjajan srebrnobijeli metal koji je postojan na zraku jer na svojoj površini stvara zaštitni sloj oksida. Staniol je naziv za tanke listiće kositra koji se koriste za zamatanje živežnih namirnica i u elektrotehnici za izradu kondenzatora. Kositar ima dvije alotropske modifikacije: sivi kositar i bijeli kositar. Rastaljeni kositar otapa mnoge metale pa tako nastaju brojne legure. Zbog lagana legiranja kositar se upotrebljava kao zaštitna prevlaka na metalima.
Oksidi metala
Kemijski spoj kisika i metala nazivamo oksid metala. Svojstva oksida metala upoznat ćete na primjerima kalcijevog oksida i željezovih oksida.
Kalcijev oksid (živo vapno), , bijela je čvrsta tvar koju najčešće dobivamo pečenjem vapnenca. Živo vapno koristi se za dobivanje gašenog vapna, žbuke, cementa, umjetnih gnojiva, za neutralizaciju i pročišćavanje otpadnih voda i dezinfekciju, u kemijskoj, prehrambenoj i tekstilnoj industriji te u poljoprivredi.
Željezo u spojevima može biti dvovalentno – željezov(II) oksid, , zelene boje.
Željezo u spojevima može biti trovalentno – željezov(III) oskid, , smeđe boje.
Željezovi oksidi nisu topljivi u vodi.
Željezo je u spojevima dvovalentno ili trovalentno, zato postoje dvije vrste oksida željeza: željezov(II) oksid, , i željezov(III) oksid, .
Kemijske spojeve željeza možete razlikovati i po boji jer su dvovalentni spojevi zelene boje, dok su trovalentni spojevi smeđe boje.
Željezovi oksidi nisu topljivi u vodi i ne stvaraju hidrokside. Dodamo li lužinu ili topljivi hidroksid otopini koja sadrži trovalentne ione željeza, pojavit će se crvenosmeđi talog željezova(III) hidroksida, .
Navedimo još neke poznatije okside metala:
magnezijev oksid,
natrijev oksid,
bakrov(II) oksid,
bakrov(I) oksid,
aluminijev oksid, .
Hidroksidi metala i lužine
Reakcijom vode i oksida metala nastaju hidroksidi metala.
Lužine su vodene otopine hidroksida metala.
Najjače lužine stvaraju hidroksidi alkalijskih metala.
Upoznat ćete kalcijev hidroksid, Ca(OH)2(s), koji još nazivamo gašeno vapno.
Kalcijev oksid burno reagira s vodom pri čemu nastaje kalcijev hidroksid i oslobađa se toplina.
Navedimo još neke poznatije okside metala:
- magnezijev oksid,
- natrijev oksid,
- bakrov(II) oksid,
- bakrov(I) oksid,
- aluminijev oksid, .
Hidroksidi metala i lužine
Reakcijom vode i oksida metala nastaju hidroksidi metala. Lužine su vodene otopine hidroksida metala. Najjače lužine stvaraju hidroksidi alkalijskih metala.
Upoznat ćete kalcijev hidroksid, , koji još nazivamo gašeno vapno. Kalcijev oksid burno reagira s vodom pri čemu nastaje kalcijev hidroksid i oslobađa se toplina.
Gašeno vapno važno je u građevinarstvu jer se koristi za ličenje zidova (zbog dezinfekcije) i pripremu žbuke (toplinska izolacija).
Znate li što je žbuka?
Kalcijev hidroksid djelomično je topljiv u vodi. Smjesa vode i kalcijevog hidroksida mutno je bijela pa se zato naziva vapneno mlijeko. Filtriranjem se može odstraniti bijeli neotopljeni talog kalcijevog hidroksida od filtrata koji je bezbojna i prozirna kalcijeva lužina, .
Još su neki poznatiji hidroksidi metala:
- natrijev hidroksid,
- kalijev hidroksid,
- magnezijev hidroksid, .
Istaknimo izuzetke:
- Hidroksidi željeza nisu topljivi u vodi i neće stvarati lužine.
- Amonijeva lužina, , tvar je bazičnih svojstava, ali u svojem sastavu nema kation metala.
Kako dokazati lužnate otopine?
Prilikom otapanja čestica hidroksida metala u vodi dolazi do rastavljanja kationa metala od hidroksidnih aniona. Ionizacija kalcijeve lužine može se prikazati kemijskom jednadžbom:
.
Lužnate otopine imaju veću količinu hidroksidnih iona, , koji će mijenjati boju indikatora.
Indikatori kojima dokazujemo lužine
Tvrdoća vode i špiljski ukrasi
Prirodne vode otapaju ugljikov(IV) oksid iz zraka i pri tome nastaje ugljična kiselina, .
Tako prirodne vode postaju kiselije.
Dok prolaze kroz tlo, reagiraju s vapnencem i pri tome nastaje kalcijev hidrogenkarbonat, , koji je otopljen u vodi.
Opisanu reakciju možemo prikazati kemijskom jednadžbom:
.
Tvrdoća vode svojstvo je koje potječe od prisutnosti otopljenih kalcijevih i magnezijevih soli u vodi.
Razlikujemo privremenu i stalnu tvrdoću vode.
Privremena tvrdoća vode ovisi o količini kalcijevog hidrogenkarbonata koji se može ukloniti kuhanjem vode.
Tvrdoća vode i špiljski ukrasi
Prirodne vode otapaju ugljikov(IV) oksid iz zraka i pri tome nastaje ugljična kiselina, . Tako prirodne vode postaju kiselije. Prolazeći kroz tlo, reagiraju s vapnencem pri čemu nastaje kalcijev hidrogenkarbonat, , koji je otopljen u vodi.
Opisanu reakciju možemo prikazati kemijskom jednadžbom:
.
Tvrdoća vode svojstvo je koje potječe od prisutnosti otopljenih kalcijevih i magnezijevih soli u vodi. Razlikujemo privremenu i stalnu tvrdoću vode. Stalna tvrdoća vode ovisi o količini kalcijevih i magnezijevih klorida i sulfata. Privremena tvrdoća vode ovisi o količini kalcijevog hidrogenkarbonata koji se može ukloniti kuhanjem vode.
Služeći se stručnom literaturom ili stručnim mrežnim stranicama, istražite što je stupanj tvrdoće vode.
Jedinica za iskazivanje tvrdoće vode jest stupanj tvrdoće vode. U Hrvatskoj se tvrdoća vode izražava masom kalcijevog karbonata u litri vode, . Ipak, u svakodnevnom životu najčešće koristimo njemačku fizikalnu jedinicu za tvrdoću vode: njemački stupanj koji se označava °nj ili °dH. Pri tome odgovara 0,056 °nj (°dH). Meke vode imaju vrijednost do 10 °nj (°dH), a tvrde vode imaju više od 15 °nj (°dH).
Pri isparavanju i kuhanju vode kalcijev hidrogenkarbonat raspada se i nastaje netopljivi kalcijev karbonat (kamenac).
Opisani proces možemo prikazati kemijskom jednadžbom:
.
Kamenac se taloži u posudama u kojima se voda kuha i na svim površinama preko kojih voda prelazi.
Nastali kamenac opažamo kao bijele ili žućkaste mrlje, a možemo ih ukloniti kiselinama (ocat, limunska kiselina) ili sredstvima za čišćenje koje sadrže kiseline.
A kako nastaju špiljski ukrasi?
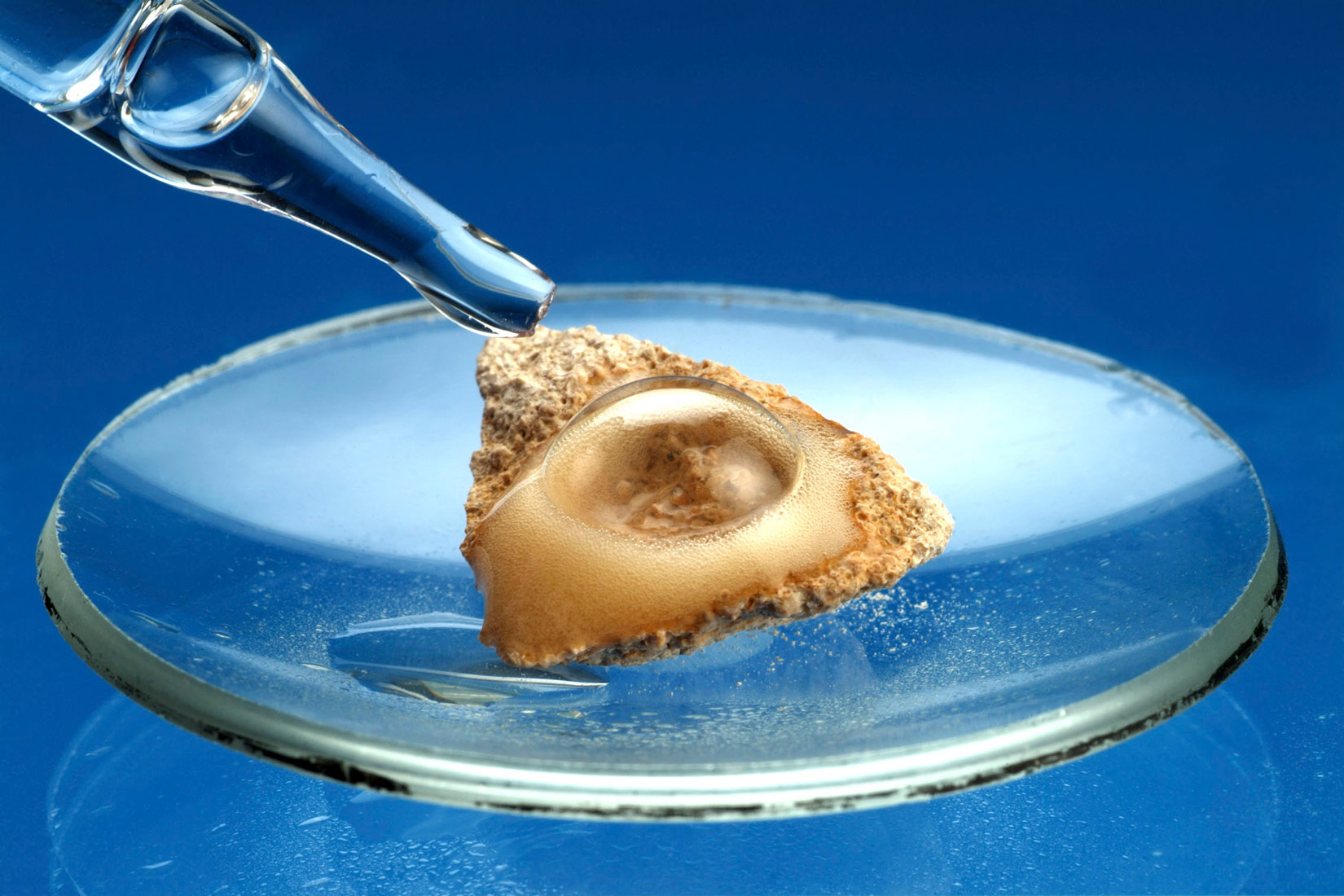
Navedite koji je mineral najzastupljeniji u sastavu tvari prikazanih na slikama ljušture školjke i stijena Nacionalnog parka Paklenica.
Dominantna tvar u sastavu ljušture školjke i vapnenačke stijene jest kalcijev karbonat, vapnenac, .
U školskim uvjetima procesom žarenja
kalcijev oksid, , i ugljikov(IV) oksid, , koji se dokazuje uvođenjem u reagens za dokazivanje ugljikovog(IV) oksida. Reagens je bistra otopina kalcijevog hidroksida koju se naziva vapnena voda. Reakcijom uvedenog ugljikovog(IV) oksida i kalcijeve lužine nastaje kalcijev karbonat koji se kao dokaz taloži na stijenkama.
Jednadžba kemijske reakcije žarenja vapnenca:
.
Na kraju…
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Litij, natrij, rubidij i francij alkalijski su metali.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Alkalijski metali u dodiru sa zrakom ne mogu se zapaliti.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite indikator s pomoću kojega možemo dokazati lužinu.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Žbuka je smjesa:
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Željezo je:
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Kisele kiše otapaju vapnenac i pri tome u prirodnim vodama nastaje sol kalcijev hidrogenkarbonat. Ta je sol uzrok povećanoj tvrdoći vode. Pri isparavanju vode kalcijev se hidrogenkarbonat raspada pa se u vodi taloži kalcijev karbonat, a istodobno se u atmosferu otpušta ugljikov dioksid. Opisane reakcije karakteristične su za stvaranje stalaktita i stalagmita u špiljama.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite jednu pogrešnu tvrdnju.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite zemnoalkalijski metal.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite pogrešnu tvrdnju.
Unesite odgovore na pripadajuća mjesta.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Željezo se nalazi u osmoj skupini i četvrtoj periodi periodnog sustava elemenata. Na zraku je nepostojano i počinje se mrviti jer na površini nastaje u vodi netopljiv spoj željezov(III) oksid. Od toga se procesa željezo može zaštititi premazivanjem bojama ili legiranjem.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Što je gašeno vapno?
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Odaberite indikatore s pomoću kojih možemo dokazati lužinu (više je odgovora točno).
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Žbuka je smjesa:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U reakciji kamenca iz posude i octene kiseline nastaju:
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Odaberite ispravne tvrdnje (više je odgovora točno).
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Kisele kiše otapaju vapnenac i pri tome u prirodnim vodama nastaje sol kalcijev hidrogenkarbonat. Ta je sol uzrok povećanoj tvrdoći vode. Pri isparavanju vode kalcijev se hidrogenkarbonat raspada pa se u vodi taloži kalcijev karbonat, a istodobno se u atmosferu otpušta ugljikov dioksid. Opisane reakcije karakteristične su za stvaranje stalaktita i stalagmita u špiljama.
Želite li pokušati ponovo?