Soli
- identificirati različite metode dobivanja soli
- prikazati proces dobivanja soli jednadžbom kemijske reakcije
- opisati svojstva, primjenu i dobivanje kuhinjske soli
- pripremiti otopinu soli zadanog sastava
- imenovati soli
- protumačiti sastav hidratne soli.
Kad čujete riječ sol, sigurno se odmah sjetite kuhinjske soli.
Kuhinjska sol sadrži u najvećoj mjeri natrijev klorid.
Danas se u kuhinjsku sol dodaje i kalijev jodid kako bi se kod ljudi spriječila bolest gušavosti.
Uvod
Čujete li riječ sol, vjerojatno odmah pomislite na kuhinjsku sol. Ona ima veliku biološku važnost, a nekada je bila korištena i kao platežno sredstvo. U najvećoj mjeri kuhinjska sol sadrži natrijev klorid. Uz prisutnost i drugih vrsta soli, danas se u kuhinjsku sol dodaje kalijev jodid radi zaštite populacije od bolesti gušavosti.
Soli možemo dobiti na različite načine. Upoznajte neke reakcije pri kojima nastaje sol.
- sinteza (spajanje) metala i nemetala
Reakcijom metala i nemetala nastaje sol. Takve su kemijske reakcije vrlo burne i oslobađaju veliku količinu energije.
2. reakcija metala i kiseline
Reakcijom metala i kiseline nastaje vodena otopina soli i plin vodik.
Predložite kako biste dokazali da je u epruveti prikupljen vodik.
Plin vodik možemo dokazati upaljenom šibicom pri otvoru epruvete. Začuje se slaba eksplozija plina praskavca – smjese prikupljenog vodika i atmosferskog kisika.
3. reakcija oksida metala i kiseline
Reakcijom oksida metala i kiseline nastaje vodena otopina soli i voda.
Zagrijavanjem bakrovog(II) oksida s razrijeđenom klorovodičnom kiselinom nastaje zelena otopina bakrovog(II) klorida (na slici desno). Reakcijom bakrovog(II) oksida s razrijeđenom sumpornom kiselinom nastaje plava otopina bakrovog(II) sulfata (na slici lijevo). Napišite kemijsku jednadžbu dobivanja te soli.
4. reakcija neutralizacije
Reakcijom kiseline i lužine nastaju sol i voda. Tu vrstu kemijskog procesa nazivamo neutralizacija.
Predložite pokus kojim biste dokazali prisutnost soli natrijevog klorida u otopini nakon reakcije neutralizacije klorovodične kiseline s natrijevom lužinom.
Uparavanjem kapljice otopine nastale reakcijom kiseline i lužine na predmetnom stakalcu ostala bi bijela mrlja natrijevog klorida, NaCl(s).
Imenovanje soli
Prisjeti se!
Ion – električki nabijen atom ili molekula.
Kation – pozitivno nabijen ion.
Anion – negativno nabijen ion.
Soli su ionski spojevi građeni od kationa metala i aniona nemetala.
Neke soli imaju sasvim obična imena, poput kuhinjske soli. Ta su imena ljudi koristili dugi niz godina pa su se održala i do današnjih dana.
Kemijska imena soli tvorimo na sljedeći način:
- imenujemo kation metala u obliku posvojnog pridjeva (magnezij → magnezijev)
- zatim imenujemo anion (karbonat) = magnezijev karbonat .
Na taj način tvorimo i druga kemijska imena soli, primjerice: amonijev klorid, NH4Cl, kalijev nitrat, itd.
Imenovanje soli
Soli su ionski spojevi građeni od kationa metala i aniona nemetala (ili aniona nemetalne skupine).
Neke soli imaju trivijalna imena, primjerice kuhinjska sol. Ta su imena nastala tijekom povijesti i koristila su se u narodu. Sustavna kemijska imena soli tvorimo tako da prvo imenujemo kation metala u obliku posvojnog pridjeva, a zatim imenujemo anion. Primjerice, magnezijev karbonat, , amonijev klorid, , kalijev nitrat, itd.
| sumporna | sulfati | amonijev sulfat | ||
|---|---|---|---|---|
| sumporasta | sulfiti | natrijev sulfit | ||
| klorovodična | kloridi | kalijev klorid | ||
| dušična | nitrati | natrijev nitrat | ||
| fosforna | fosfati | kalcijev fosfat | ||
| ugljična | karbonati | magnezijev karbonat |
Provjerite svoje znanje o postupcima dobivanja soli.
Sastav hidratne soli
Neke soli mogu osim kationa metala i aniona nemetala sadržavati i molekule vode.
Takvu vodu nazivamo kristalna voda, a takvu sol nazivamo hidratna sol.
Zagrijavanjem hidratne soli voda isparava, a ostaje bezvodna sol koju nazivamo anhidrid.
Sastav hidratne soli
Neke soli imaju u svojem sastavu, uz katione metala i anione nemetala, i neku količinu molekula vode. Tu se vodu naziva kristalnom vodom, a sol se naziva
Zagrijavanjem hidratne soli voda ispari, a preostane bezvodna (dehidrirana) sol koju se naziva anhidrid. To se, primjerice, događa zagrijavanjem modre galice koja se pri tome razlaže na bakrov(II) sulfat i vodu.
Neke su hidratne soli:
željezov(II) sulfat heptahidrat, ,
FeSO4 ∙ 7H2O,
zelena galica
kobaltov(II) klorid heksahidrat,
magnezijev sulfat heptahidrat,
MgSO4 ∙ 7H2O, gorka sol
Neke su hidratne soli:
željezov(II) sulfat heptahidrat, , zelena galica
kobaltov(II) klorid heksahidrat,
magnezijev sulfat heptahidrat, , gorka sol.
Ove prirodne ljepote “kriju” se u dubini Zemlje (rudnik Naica u meksičkoj državi Chihuahua). Istražite o kojem je mineralu riječ.
Naica je rudnik olova, cinka i srebra, a najpoznatiji je po svojim izvanrednim kristalima selenita koji mogu težiti i do 55 tona. Selenit je gust, vlasast ili vlaknast agregat gipsa, , svilenasta sjaja.
Svojstva, primjena i dobivanje kuhinjske soli
Kuhinjska sol:
- homogena smjesa raznih soli
- najzastupljenija je sol u kuhinjskoj soli natrijev klorid
- kristali natrijevog klorida bezbojni su, prozirni, kubične strukture, slana okusa i dobro su topljivi u vodi
Svojstva, primjena i dobivanje kuhinjske soli
Kuhinjska je sol homogena smjesa raznih soli, no najzastupljenija je sol natrijev klorid. Kristali natrijevog klorida bezbojni su, prozirni i kubične strukture. Slana su okusa i dobro su topljivi u vodi. Natrijev klorid ima visoko vrelište zbog jakih ionskih veza između kationa natrija i aniona klora.
Kuhinjsku sol upotrebljavamo na sljedeće načine:
- u prehrani – kao začin i konzervans (za dugo čuvanje hrane)
- u medicini – za ispiranje rana i za infuziju (fiziološka otopina)
- u industriji – pri proizvodnji kože, tekstila, stakla, papira, sapuna.
Najznačajnija primjena kuhinjske soli jest u prehrani kao začin i konzervans. U medicini se koristi vodena otopina natrijevog klorida masenog udjela 0,9 % za ispiranje rana i za infuziju i naziva se fiziološka otopina. Kuhinjska sol koristi se u industriji kože, tekstila, stakla, papira i sapuna. U kemijskoj industriji polazna je sirovina za proizvodnju mnogih spojeva. Upoznajmo neke načine proizvodnje kuhinjske soli.

Rudnici soli
Slični rudnici soli najbliži Hrvatskoj nalaze se u Tuzli u Bosni i Hercegovini, u okolici Salzburga u Austriji te u Njemačkoj. Imena obaju gradova povezani su sa solju. Na turskom „tuz“ znači sol. U predtursko vrijeme Tuzla se zvala Soli, a u doba rimskog imperija Salines. Rudnici su bili eksploatirani već u pretpovijesno doba. Svjetski poznat rudnik soli Wieliczka u Poljskoj blizu Krakowa pretvoren je u muzej s umjetničkim skulpturama izrađenima od soli. U rudniku se također nalazi slani sanatorij za liječenje osoba s dišnim smetnjama. Rudnik soli u gradu Turda u Rumunjskoj također je pretvoren u moderan zabavni park.
Proučite sliku. Potom na mrežnim stranicama Maker National Geographica, u alatu Map Maker na praznoj karti označite položaj mora/jezera za koji pretpostavljate da prikazuje obalni pojas sa slike.
Slika prikazuje obalni pojas Mrtvog mora (Jordan).
Priprema otopine soli zadanog sastava
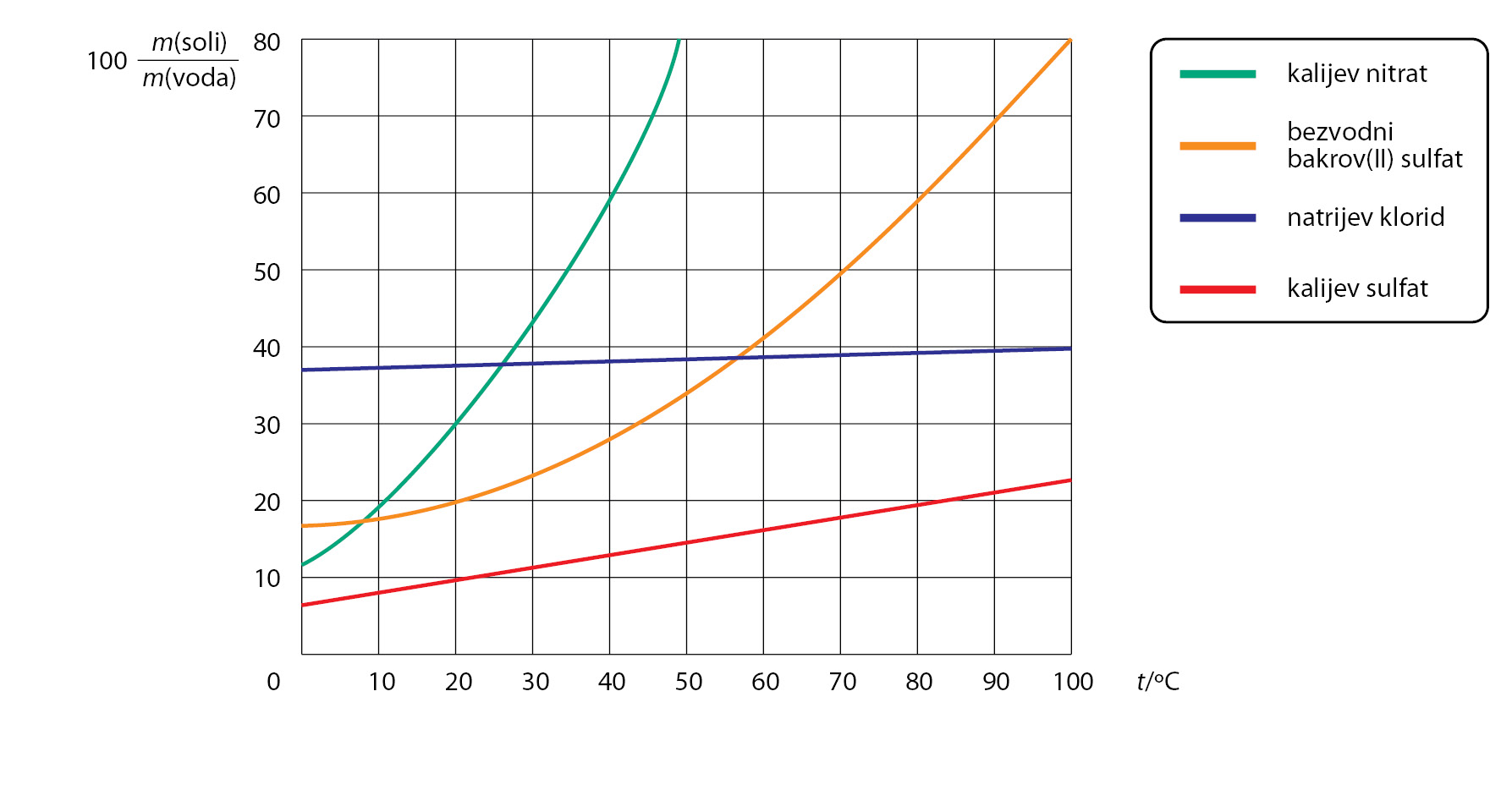
U svakodnevnom životu ponekad ćete trebati pripremiti otopinu neke soli. Ta je vještina veoma korisna. Prisjetite se da ste na satima kemije u sedmom razredu naučili da postoje tri tipa otopine prema količini otopljene tvari u otapalu. To su nezasićena, zasićena i prezasićena otopina. Najčešće ćete trebati pripraviti nezasićene otopine soli. Dobro je znati kako se mijenja topljivost soli s promjenom temperature, a takvi podatci najlakše se uočavaju na grafikonu topljivosti soli.
Kako pripremiti otopinu soli zadanoga masenog udjela?
Korak 1.
Sastav otopine može se iskazati na više načina. Jedan je od njih vrijednost masenog udjela otopljene tvari u otapalu. Vrijednost masenog udjela najčešće se iskazuje u postotcima.
Korak 2.
Formula masenog udjela tvari u otopini:
Korak 3.
Pripremimo 120 g fiziološke otopine – otopina u kojoj je maseni udio natrijevog klorida 0,9 % u sterilnoj vodi. Izračunajte masu soli i masu vode potrebne za traženu otopinu.
Korak 4.
Primijenimo navedenu formulu za račun masenog udjela tvari u otopini i izračunajmo potrebnu masu soli.
Korak 5.
Od ukupne mase otopine oduzmemo masu soli i dobijemo masu vode u otopini.
S obzirom na to da je gustoća vode 1 g/cm3, uzorak ove otopine mogli bismo pripremiti otapanjem 1,08 g natrijevog klorida u 118,9 cm3 vode.
Što se događa s kristalom natrijevog klorida tijekom otapanja u vodi?
Otapanje natrijevog klorida u vodi prikazujemo:
.
Dobro je znati kako se mijenja topljivost soli s promjenom temperature, a takvi podatci najlakše se uočavaju na grafikonu topljivosti soli.
Na kraju…
Ponovite osnovne pojmove vezane za soli te riješite interaktivni kviz!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kuhinjska sol sadrži najviše:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Dobivanje morske soli u solanama temelji se na postupku:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Sol bakra izrazito plave boje zove se:
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Kristali natrijevog klorida:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite tvar koja se koristi za izradu gipsanih zavoja.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Dobivanje morske soli u solanama temelji se na postupku:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite niz u kojem su točno napisane sve oznake soli.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Odaberite točne tvrdnje (dva su odgovora točna).
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Odaberite kemijsku reakciju kojom će nastati sol.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Ozren treba pripremiti 50 %-tnu otopinu kuhinjske soli. Koju masu tvari i otapala Ozren treba uzeti? Koliko je otopine pripremljeno?
Želite li pokušati ponovo?