Podjela tvari i postupci odjeljivanja tvari
- razlikovati čiste tvari od smjesa tvari
- prepoznati vrste smjesa
- pripremiti homogenu i heterogenu smjesu
- primijeniti postupke odjeljivanja tvari.
Uvod
Ponovite gradivo kemije osnovne škole (jedinica 3.4 Građa elementarnih tvari i kemijskih spojeva u DOS-u Kemija 7) i riješite sljedeći zadatak.
Rješavajući zadatak prisjetili ste se da se kemijski spojevi sastoje od raznovrsnih atoma, a njihov se sastav prikazuje kemijskom formulom, npr. vapnenac: , bakrov(II) oksid: , natrijev klorid: , sumporna kiselina: .
Različitim kemijskim postupcima kemijski se spojevi mogu rastaviti na jednostavnije spojeve ili elementarne tvari. No, možemo li sve tvari analizom rastaviti, a sintezom proizvesti?
Podjela tvari
Po svojim su svojstvima tvari vrlo različite i može ih se podijeliti u nekoliko skupina kao što je prikazano sljedećim shematskim prikazom.
U svijetu se za pojedine kemijske elemente rabe različita imena. Tako će se kemijski element dušik na različitim jezicima različito nazivati.
Svjetski kemičari teško bi se međusobno
sporazumijevali da prvi kemičari i alkemičari,
nisu pokušavali tvari koje su poznavali
označiti nekim posebnim znakovima.
Prvo sustavno označavanje kemijskih elemenata
postojalo je već u starih Grka i Kineza.
l alkemičari su imali svoju simboliku.
Velik je napredak učinio John Dalton uvevši simbol za svaki element.
Svjetski bi se kemičari teško međusobno sporazumijevali da već prvi kemičari, pa i alkemičari, nisu pokušavali tvari koje su poznavali obilježiti nekim posebnim znakovima. Prvo sustavno označavanje kemijskih elemenata postojalo je već u starih Grka i Kineza. l alkemičari su imali svoju simboliku. Velik je napredak učinio John Dalton uvevši simbol za svaki element.
Formula spoja napisana Daltonovim simbolima bila je vrlo nepregledna i nespretna.
Bila je sastavljena od onoliko simbola
koliko atoma ima u molekuli.
To je bilo teško zapisivati na takav način.
Mnoge tvari za koje danas znamo, a složenije su strukture,
u ona su vremena bile smatrane elementima.
Kemijsku simboliku koju danas rabimo
predložio je švedski znanstvenik J. J. Berzelius 1814. godine.
Za simbol kemijskog elementa uzeo je
početno slovo njegova latinskog imena.
Za simbole elemenata čija imena počinju istim slovom
početnom je slovu dodao još jedno slovo iz njihova latinskog imena (sljedeća tablica).
| Ime elementa | simbol elementa | |
|---|---|---|
| hrvatsko | latinsko | |
| ugljik | Carboneum | C |
| cezij | Cesium | Cs |
| kalcij | Calcium | Ca |
| kadmij | Cadmium | Cd |
| krom | Cromium | Cr |
Formule složenijih spojeva prikazane Daltonovom simbolikom bile su vrlo nepregledne i nespretne za pisanje, jer su bile sastavljene od onoliko simbola koliko je atoma bilo pojedinoj molekuli. Valja naglasiti kako su mnoge tvari za koje danas znamo, a složenije su strukture, u ona vremena bile smatrane elementima.
Kemijsku simboliku koju danas rabimo predložio je švedski znanstvenik J. J. Berzelius 1814. godine. Za simbol kemijskog elementa uzeo je početno slovo njegova latinskog imena. Za simbole elemenata čija imena počinju istim slovom početnom je slovu dodao još jedno slovo iz njihova latinskog imena (sljedeća tablica).
| Ime elementa | simbol elementa | |
|---|---|---|
| hrvatsko | latinsko | |
| ugljik | Carboneum | C |
| cezij | Cesium | Cs |
| kalcij | Calcium | Ca |
| kadmij | Cadmium | Cd |
| krom | Cromium | Cr |
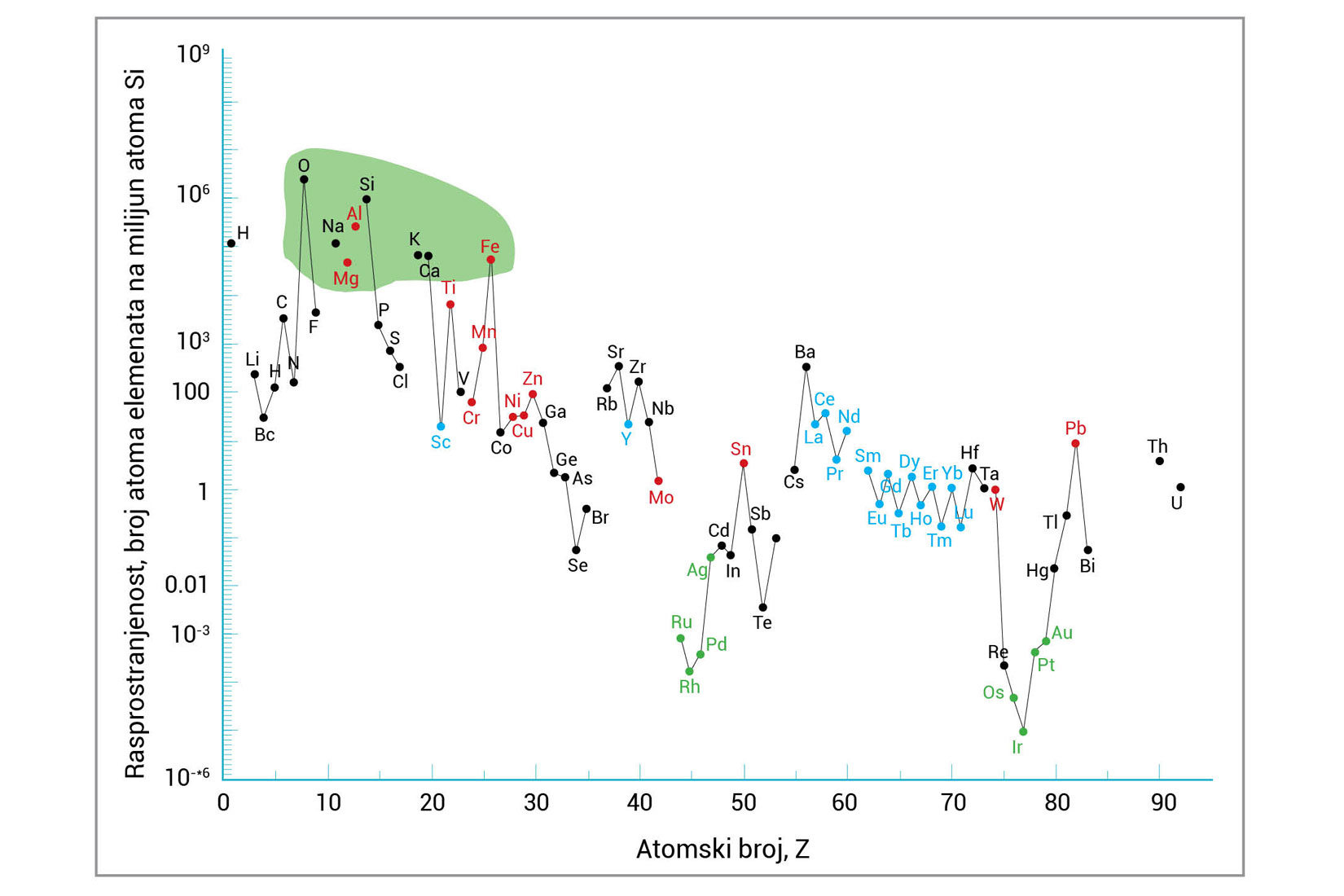
Rasprostranjenost elemenata
U Zemljinoj kori, na planetu Zemlji i u svemiru
U Zemljinoj kori većinu elemenata nalazimo u spojevima.
Relativno mali broj elemenata možemo naći u elementarnom stanju.
To su bakar, živa, ugljik, sumpor, srebro ili zlato.
Maseni udio različitih elemenata u Zemljinoj kori vrlo je različit.
Svega pet elemenata čini 91,0% Zemljine kore.
Prema središtu Zemlje sve je više elemenata veće gustoće.
Nasuprot tomu, u svemiru prevladavaju lakši elementi.
| Raspodjela elemenata u Zemljinoj kori | Raspodjela elemenata na planetu Zemlji | Raspodjela elemenata u svemiru | |||
|---|---|---|---|---|---|
| element | w/% | element | w/% | element | w/% |
| kisik (O) | 46,6 | željezo (Fe) | 34,0 | vodik (H) | 60,4 |
| silicij (Si) | 27,7 | kisik (O) | 29,5 | helij (He) | 36,6 |
| aluminij (Al) | 8,1 | silicij (Si) | 15,2 | ||
| željezo (Fe) | 5,0 | magnezij (Mg) | 12,7 | ||
| kalcij (Ca) | 3,6 | nikal (Ni) | 2,4 | ||
| Ukupno: | 91,0 | Ukupno: | 93,8 | Ukupno: | 97,0 |
Rasprostranjenost elemenata
U Zemljinoj kori, na planetu Zemlji i u svemiru
U Zemljinoj kori većinu elemenata nalazimo u spojevima. Relativno mali broj elemenata, poput bakra, žive, ugljika, sumpora, srebra ili zlata, možemo naći u elementarnom stanju. Maseni udio različitih elemenata u Zemljinoj kori vrlo je različit tako da svega pet elemenata čini 91,0% Zemljine kore. Prema središtu Zemlje sve je više elemenata veće gustoće. Nasuprot tomu, u svemiru prevladavaju lakši elementi.
| Raspodjela elemenata u Zemljinoj kori | Raspodjela elemenata na planetu Zemlji | Raspodjela elemenata u svemiru | |||
|---|---|---|---|---|---|
| element | w/% | element | w/% | element | w/% |
| kisik (O) | 46,6 | željezo (Fe) | 34,0 | vodik (H) | 60,4 |
| silicij (Si) | 27,7 | kisik (O) | 29,5 | helij (He) | 36,6 |
| aluminij (Al) | 8,1 | silicij (Si) | 15,2 | ||
| željezo (Fe) | 5,0 | magnezij (Mg) | 12,7 | ||
| kalcij (Ca) | 3,6 | nikal (Ni) | 2,4 | ||
| Ukupno: | 91,0 | Ukupno: | 93,8 | Ukupno: | 97,0 |
Prema tabličnim podatcima napravite grafičke prikaze.
Prikažite raspodjelu elemenata u Zemljinoj kori,
raspodjelu elemenata na planetu Zemlji i raspodjelu elemenata u svemiru.
Za izradu grafikona možete se poslužiti digitalnim alatom Meta-Chart.
Na temelju tabličnih podataka i dobivenih grafikona zaključite koja su četiri elementa najzastupljenija u sastavu planeta Zemlje.
Prema tabličnim podatcima napravite grafičke prikaze kojima ćete prikazati raspodjelu elemenata u Zemljinoj kori, raspodjelu elemenata na planetu Zemlji i raspodjelu elemenata u svemiru. Za izradu grafikona možete se poslužiti digitalnim alatom Meta-Chart.
Na temelju tabličnih podataka i dobivenih grafikona zaključite koja su četiri elementa najzastupljenija u sastavu planeta Zemlje.
Pomoću podataka iz grafa nadopunite sljedeće tvrdnje.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
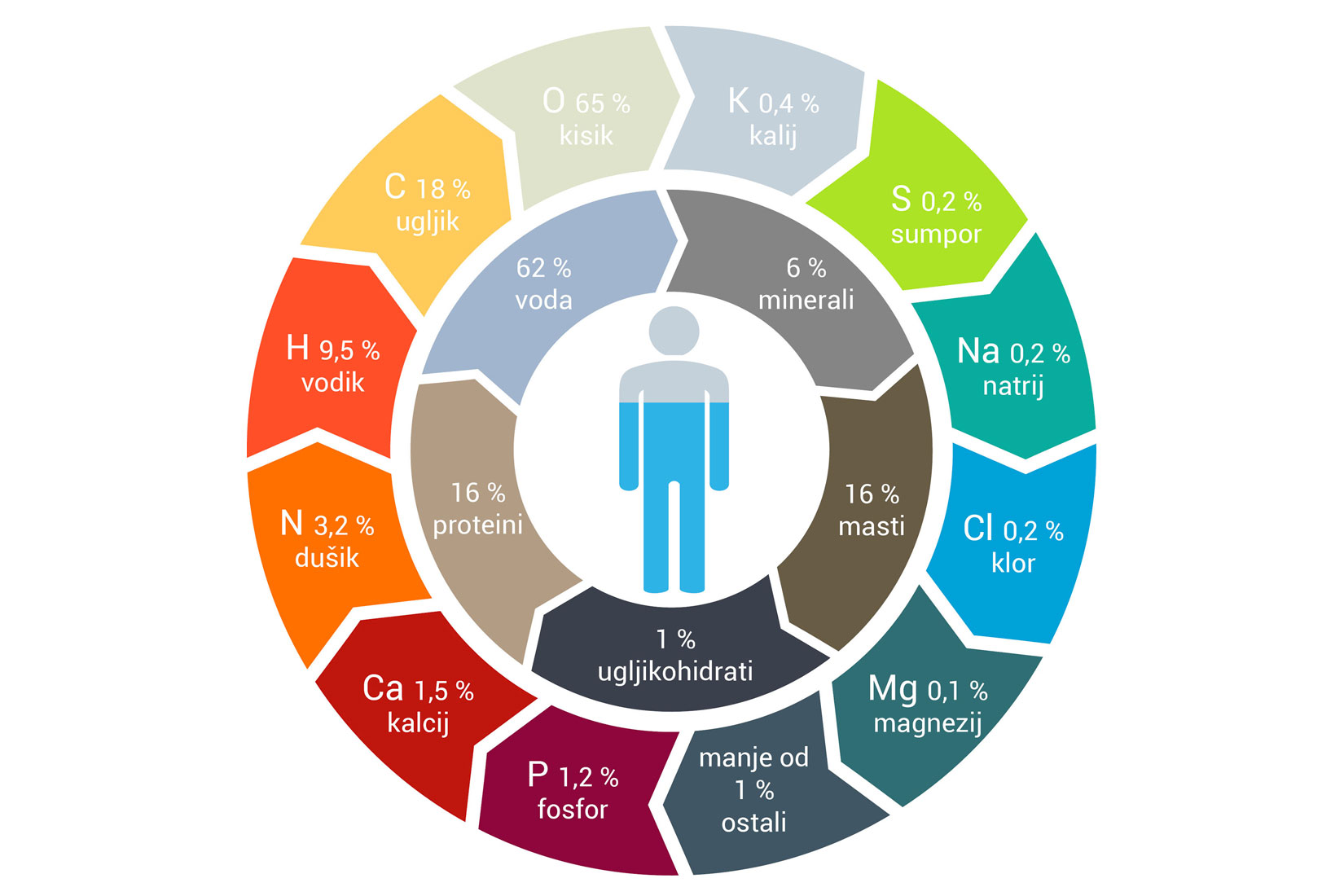
A od čega je građen ljudski organizam?
Svi elementi koji izgrađuju naš organizam nazivaju se bitnim ili esencijalnim elementima. Esencijalni elementi se u našem organizmu nalaze u obliku iona (kationa i aniona) i molekula (anorganskih ili organskih).
Razlikujemo esencijalne makroelemente,
esencijalne mikroelemente i esencijalne elemente u tragovima.
Esencijalni makroelementi potrebni su organizmu u većim količinama.
Nazivamo ih i organogenim elementima.
To su ugljik, vodik, kisik i dušik.
Esencijalnim makroelementima pripadaju još i nemetali
fosfor, sumpor te klor, a od metala natrij, kalij, magnezij i kalcij.
Esencijalne mikroelemente organizam treba u maloj količini.
To su, primjerice, željezo, mangan, cink, bakar i dr.
Esencijalnim elementima u tragovima (potencijalni mikroelementi) do danas nije do kraja poznata fiziološka uloga u organizmu.
Primjerice, to su titanij, aluminij, silicij, brom i dr.
Razlikujemo esencijalne makroelemente, esencijalne mikroelemente i esencijalne elemente u tragovima.
Esencijalni makroelementi potrebni su organizmu u većim količinama i nazivamo ih i organogenim elementima. To su ugljik, vodik, kisik i dušik. Esencijalnim makroelementima pripadaju još i nemetali fosfor, sumpor te klor, a od metala natrij, kalij, magnezij i kalcij.
Esencijalne mikroelemente organizam treba u maloj količini. To su, primjerice, željezo, mangan, cink, bakar i dr.
Esencijalnim elementima u tragovima (potencijalni mikroelementi) do danas nije do kraja poznata fiziološka uloga u organizmu. Primjerice, to su titanij, aluminij, silicij, brom i dr.
Elementi života
Proučite infografiku i odgovorite na sljedeća pitanja.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Neke metode razdvajanja smjesa
Tvari se u prirodi najčešće nalaze kao smjese dviju ili više tvari.
Smjesu možemo razdvojiti na sastojke
zahvaljujući različitim fizikalnim i kemijskim svojstvima pojedinih sastojaka.
Neke metode razdvajanja smjesa
Tvari se u prirodi najčešće nalaze kao smjese dviju ili više tvari. Smjesu možemo razdvojiti na sastojke prema različitim fizikalnim i kemijskim svojstvima pojedinih sastojaka.
Predložite postupke kojima biste odijelili sastojke heterogene smjese vodene otopine bakrova(II) sulfata i sumpora.
Za odjeljivanje sastojaka smjesu se prvo filtrira. Na filtrirnom papiru ostaje sumpor, a filtrat je otopina bakrova(II) sulfata. Filtrat se lagano zagrijava u porculanskoj zdjelici, pri čemu voda isparava, a ostaju modri kristalići bakrova(II) sulfata pentahidrata, . Duljim se zagrijavanjem izdvaja kristalno vezana voda iz bakrove soli i zaostaje bijeli prah bezvodnog bakrova(II) sulfata, .
Destilacija
Zbog višestruke primjene destilacije razvili su se različiti postupaci i destilacijski uređaji.
Koriste se različite aparature,
od staklenih laboratorijskih aparature do metalnih industrijskih aparatura.
Destilirati se može pri atmosferskom, povišenom ili sniženom tlaku.
Destilacija (lat. destillatio = kapanje) je postupak odvajanja tekućine (otapala)
od otopljene, nehlapljive tvari.
Zagrijavanjem tekućina prelazi u paru.
Para se prolaskom kroz hladilo kondenzira i skuplja u predlošku.
Dobivena se tekućina naziva destilat.
Otopljena tvar ostaje u tikvici za destilaciju.
Destilacija
Višestruka primjena destilacije uvjetovala je razvoj različitih postupaka i destilacijskih uređaja, od staklenih laboratorijskih aparatura do metalnih industrijskih aparatura. Destilirati se može pri atmosferskom, povišenom ili sniženom tlaku.
Destilacija (lat. destillatio = kapanje) je postupak odvajanja tekućine (otapala) od otopljene, nehlapljive tvari. Zagrijavanjem tekućina prelazi u paru koja se prolaskom kroz hladilo kondenzira i skuplja u predlošku. Dobivena se tekućina naziva destilat. Otopljena tvar ostaje u tikvici za destilaciju.
Frakcijska destilacija
Frakcijska destilacija je postupak sličan običnoj destilaciji.
Izvodi se u posebnoj aparaturi s frakcijskom kolonom.
Parna faza nastala destilacijom se kondenzira.
Dobiveni kondenzat se ponovno destilira.
Postupak se ponavlja više puta.
Parna faza uvijek sadrži
više lakše hlapljive komponente od tekuće faze.
Zato na vrhu kolone izlazi para čiste lakše hlapljive komponente.
Na dnu je tekućina teže hlapljive komponente.
Frakcijska destilacija je postupak sličan običnoj destilaciji, ali se izvodi u posebnoj aparaturi s frakcijskom kolonom, i to tako da se destilacijom nastala parna faza kondenzira, a dobiveni kondenzat ponovno destilira. Postupak se ponavlja više puta. Kako parna faza uvijek sadrži više lakše hlapljive komponente od tekuće faze, na vrhu kolone izlazi para čiste lakše hlapljive komponente, a na dnu ostaje tekućina teže hlapljive komponente.

Destilacija vodenom parom
Destilacija ekstrakta biljaka radi dobivanja eteričnih ulja
rabi se još od petnaestog stoljeća.
Ulje kamilice upotrebljava se u kozmetičkoj i farmaceutskoj industriji.
To ulje ima antiflogističko i protuupalno djelovanja.
Karakterističnu plavu boju ulju kamilice daje spoj kamazulen.
Kamazulen u biljci nastaje kemijskim procesom tijekom destilacije vodenom parom.
Destilacija vodenom parom temelji se na svojstvu nekih tvari,
koje se ne miješaju s vodom.
Te tvari destiliraju zajedno s vodenom parom pri temperaturi nižoj od njihova vrelišta.

Destilacija vodenom parom
Destilacija ekstrakta biljaka radi dobivanja eteričnih ulja rabi se još od petnaestoga stoljeća. Ulje kamilice upotrebljava se u kozmetičkoj i farmaceutskoj industriji zbog svog antiflogističkog i protuupalnog djelovanja. Karakterističnu plavu boju ulju kamilice daje spoj kamazulen, koji u biljci nastaje kemijskim procesom tijekom destilacije vodenom parom.
Destilacija vodenom parom temelji se na svojstvu nekih tvari, koje se ne miješaju s vodom, da destiliraju zajedno s vodenom parom pri temperaturi nižoj od njihova vrelišta.
Ekstrakcija
Ekstrakcija je postupak izdvajanja tvari
iz homogenih smjesa.
Ekstrakcija se temelji na različitoj topljivosti tvari
u dva otapala koja se međusobno ne miješaju.
Postupak se provodi u lijevku za odjeljivanje.
Jod je slabo topljiv u vodi,
a dobro topljiv u kloroformu.
Voda i kloroform su otapala
koja se međusobno ne miješaju.
Dodamo li kloroform u vodenu otopinu joda,
jod će nakon mućkanja smjese prijeći u kloroform.
To se događa zbog topljivosti.
Bolji učinak ekstrakcije postiže se
ekstrahiranjem više puta s manjom količinom otapala.
Ekstrakcija
Ekstrakcija je postupak izdvajanja tvari iz homogenih smjesa na temelju njihove različite topljivosti u dva otapala koja se međusobno ne miješaju. Postupak se provodi u lijevku za odjeljivanje. Primjerice, jod je slabo topljiv u vodi, a dobro topljiv u kloroformu. Voda i kloroform su otapala koja se međusobno ne miješaju. Dodamo li kloroform u vodenu otopinu joda, jod će nakon mućkanja smjese zbog bolje topljivosti prijeći u kloroform. Bolji učinak ekstrakcije postiže se višekratnim ekstrahiranjem s manjom količinom otapala.
Na temelju slikovnih priloga u fotogaleriji izvedite zaključke prema opisu ekstrakcije joda iz vodene otopine pomoću kloroforma i odgovorite na pitanja.
Ekstrakcija joda iz vodene otopine pomoću kloroforma
Pitanja:
- Što se nalazi u gornjem sloju, a što u donjem nakon što se slojevi odijele ekstrakcijom?
- Zašto se jod bolje otapa u kloroformu nego u vodi?
- Može li se neka tvar višestrukim ekstrahiranjem potpuno ekstrahirati iz otopine? Prodiskutirajte svoja zapažanja.
Odgovori na pitanja:
-
- Nakon ekstrakcije u gornjem sloju ostaje vodena otopina joda, a u donjem sloju otopina joda u kloroformu.
Osnovno pravilo ekstrakcije je da tvari koje odjeljujemo moraju biti topljive u različitim otapalima te da se otapala međusobno ne miješaju. - Nepolarne molekule joda bolje se otapaju u kloroformu nego u vodi koja je izrazito polarno otapalo.
- Višestrukim ekstrahiranjem ne može se iz neke smjese potpuno izdvojiti određena tvar jer je omjer množinskih koncentracija otopljene tvari između dvaju otapala stalan uz stalnu temperaturu.
- Nakon ekstrakcije u gornjem sloju ostaje vodena otopina joda, a u donjem sloju otopina joda u kloroformu.
Kromatografija
Kromatografija je postupak razdvajanja
čistih tvari iz homogenih tekućih ili plinovitih smjesa.
Metoda se zasniva na različitoj brzini
putovanja iona ili molekula nošenih otapalom po nepokretnoj fazi.
Nepokretna faza je najčešće neki čvrsti nosač velike površine.
Razlikujemo kromatografiju u stupcu, na papiru i na tankom sloju.
Pri kromatografiji u stupcu
nosač je najčešće stupac kalcijevog karbonata.
Pri kromatografiji na papiru
nosač je specijalna vrsta filtrirnog papira.
Pri kromatografiji na tankom sloju nosač je
tanki sloj silikagela nanesen na staklenu ploču.
Za razdvajanje plinskih smjesa primjenjuje se plinska kromatografija.
Kromatografija
Kromatografija je postupak razdvajanja čistih tvari iz homogenih tekućih ili plinovitih smjesa. Metoda se zasniva na različitoj brzini putovanja iona ili molekula nošenih otapalom po nepokretnoj fazi. Nepokretna faza je najčešće neki čvrsti nosač velike površine.
Razlikujemo kromatografiju u stupcu, u kojoj je nosač najčešće stupac kalcijeva karbonata, kromatografiju na papiru, u kojoj je nosač specijalna vrsta filtrirnog papira, i kromatografiju na tankom sloju, u kojoj je nosač tanki sloj silikagela nanesen na staklenu ploču. Za razdvajanje plinskih smjesa primjenjuje se plinska kromatografija.
Na kraju…
Primijenite istraživački utemeljeno učenje u suradnji s drugim učenicima!