Metalno vezivanje
- opisati pojam delokaliziranog elektronskog oblaka
- povezati značajke metalnog vezivanja sa svojstvima metala
- opisati poluvodiče n-tipa i p-tipa
Uvod
U svakodnevnom životu koristimo nebrojeno mnogo metalnih predmeta što ukazuje na veliku važnost metala u našem životu.
Neki od metala imaju i veliku biološku važnost jer njihove atome nalazimo u građi mnogih biološki važnih molekula kao što su hemoglobin, mioglobin, klorofil, vitamin B12 i drugi.
U kojem će se obliku nalaziti metali u prirodi ovisi o njihovim kemijskim svojstvima.
Bakar , srebro i zlato se u prirodi mogu naći u elementarnom stanju.
To je zbog njihove vrlo slabe reaktivnosti.
Alkalijske metale se u prirodi isključivo može naći u obliku spojeva i različitih metala.
Isto vrijedi za mnoge druge jako reaktivne metale.
Minerali su prirodni sastojci Zemljine kore.
Neki od minerala su važne sirovine za dobivanje metala.
Minerale iz kojih je dobivanje metala isplativo nazivamo rudama.
Slitine ili legure nastaju miješanjem dvaju ili više metala u rastaljenom stanju.
Mogu nastati miješanjem metala i nemetala (npr.ugljika).
Uporaba slitina ili legura je danas vrlo raširena.
Primjeri slitina su:
- bronca (slitina bakra i kositra),
- mjed (slitina bakra i cinka),
- čelik (slitina željeza i ugljika, ili nikla ili mangana, silicija),
- duraluminij (slitina aluminija s bakrom, magnezijem, manganom i silicijem),
- magnalij (slitina aluminija s magnezijem) i druge.
U kojem će se obliku nalaziti metali u prirodi ovisi o njihovim kemijskim svojstvima.
Bakar, srebro i zlato se zbog svoje vrlo slabe reaktivnosti u prirodi mogu naći u elementarnom stanju.
Alkalijski se metali, kao i mnogi drugi reaktivni metali, u prirodi mogu naći u mineralima, odnosno u spojevima. Minerali su prirodni sastojci Zemljine kore. Neki od njih važne su sirovine za dobivanje metala. Minerale iz kojih je dobivanje metala isplativo nazivamo rudama.
Miješanjem dvaju ili više metala, ponekad i nemetala (ugljik) u rastaljenom stanju, nastaju slitine (legure) čija je uporaba danas vrlo raširena.
Primjeri slitina su bronca (slitina bakra i kositra), mjed (bakra i cinka), čelik (željeza i ugljika), duraluminij (aluminija s bakrom, magnezijem, manganom i silicijem), magnalij (aluminija s magnezijem) i druge.
Karakteristična svojstva metala
Od svih do danas poznatih elemenata otprilike 4/5 su metali.
Metali imaju neka slična svojstva, bez obzira na položaj u PSE-a.
Fizikalna svojstava metala su:
- AGREGACIJSKO STANJE– Svi su metali pri sobnoj temperaturi čvrste kristalne tvari osim žive koja je tekućina.
- BOJA – Većina je metala sive boje, srebrnog sjaja, osim bakra koji je crvenkaste i zlata žute boje. Sjajna površina metala reflektira svjetlost.
- KOVKOST – Mogu se kovati i izvlačiti u žice i tanke folije.
- VODLJIVOST -Dobri su vodiči struje i topline.
- GUSTOĆA
- -Jedno od svojstava po kojima se metali mogu
jako razlikovati je gustoća.
Od svih metala litij ima najmanju gustoću, samo 0,534 g/cm3.
Osmij najveću 22,59 g/cm3.
Karakteristična svojstva metala
Od svih do danas poznatih elemenata otprilike 4/5 su metali. Metali bez obzira na položaj u PSE-a imaju neka slična svojstva. Od fizikalnih svojstava, metalima su svojstveni:
- Agregacijsko stanje
Svi su metali pri sobnoj temperaturi čvrste kristalne tvari osim žive koja je tekućina.
- Boja
Većina je metala sive boje, srebrnog sjaja, osim bakra koji je crvenkastosmeđe i zlata žute boje. Sjajna površina metala reflektira svjetlost.
- Kovkost
Mogu se kovati i izvlačiti u žice i tanke folije.
- Vodljivost
Dobri su vodiči struje i topline.
Navedena svojstva zajednička su većini metala, dok se talište i gustoća metala mogu jako razlikovati.
- Gustoća
Jedno od svojstava po kojima se metali mogu jako razlikovati je gustoća. Od svih metala litij ima najmanju gustoću, samo 0,534 g/cm3, a osmij najveću 22,59 g/cm3.
U digitalnoj inačici PSE-a, pronađite metale 4 periode. Služeći se programom Microsoft Excel Online oblikujte tablicu u koju upišite vrijednosti njihovih tališta i gustoća. Te podatke prikažite i grafički. Proučite kako se te vrijednosti mijenjaju kroz periodu.
Odgovor:
Najniža tališta imaju alkalijski metali na početku periode.
Tališta metala kroz 4. periodu rastu prema središtu PSE (najviša su kod prijelaznih metala), a potom njihove vrijednosti opadaju prema cinku.
Gustoća metala u periodi raste porastom protonskog broja do bakra.
Metalni sjaj, električna i toplinska vodljivost su svojstva metala i posljedica su razlika u njihovoj strukturi.
Interakcije atoma u strukturi metala nazivamo metalnim vezivanjem.
Metalno vezivanje
Jedna od prvih teorija kojom se pokušalo objasniti
nastajanje metalne veze bila je
elektronska teorija na samom početku 20. stoljeća.
Ako je udaljenost između atoma metala dovoljno mala,
atomi će se pravilno razvrstati.
Svi valentni elektroni će činiti zajednički elektronski oblak.
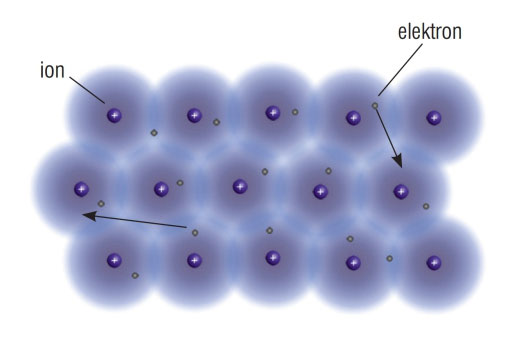
Atome metala možemo zamisliti kao pozitivne metalne ione
u elektronskom oblaku valentnih elektrona.
Različita svojstva metala (metalni sjaj, električna i toplinska vodljivost) u odnosu na svojstva ionskih i kovalentnih spojeva, posljedica su razlika u njihovoj strukturi. Interakcije atoma u strukturi metala nazivamo metalnim vezivanjem.
Metalno vezivanje
Jedna od prvih teorija kojom se pokušalo objasniti nastajanje metalne veze bila je elektronska teorija na samom početku 20. stoljeća. Ako je udaljenost između atoma metala dovoljno mala, atomi će se pravilno razvrstati tako da svi valentni elektroni čine zajednički elektronski oblak. Prema tome atome metala možemo zamisliti kao pozitivne metalne ione u elektronskom oblaku valentnih elektrona.
Valentni se elektroni u metalu slobodno premještaju.
Gibaju se od iona do iona.
Veza koja povezuje ione (katione) metala
i elektrone elektronskog oblaka je metalna veza.
Zbog suprotnih naboja pozitivnih metalnih iona i negativnih elektrona
metalne veze su vrlo jake.
Razlog su vrlo visokih tališta i vrelišta kristala metala.
Već ste zaključili da su tališta i gustoće prijelaznih metala visoka.
Tališta i vrelišta metala su visoka
jer se jedinke metala povezuju jakom metalnom vezom.
U atomima prijelaznih metala broj
nesparenih elektrona u d-orbitalama raste od 1 do 5.
Nespareni elektroni povećavaju jakost metalne veze.
Veza je jača što je broj nesparenih elektrona u atomima metala veći.
Atomi cinka, kadmija žive imaju sve d-elektrone sparene.
Njihova su tališta i vrelišta relativno niska.
Atom žive veći od atoma cinka i kadmija.
Njegovi valentni elektroni u 6s orbitali su jako udaljeni od jezgre.
Privlačna sila između jezgre i valentnih elektrona vrlo slaba.
To je razlog da je živa jedini metal
koji je pri sobnoj temperaturi u tekućem agregacijskom stanju.
Teorija elektronskih vrpci
Tridesetak godina kasnije metalna se veza
tumači teorijom elektronskih vrpci.
U kristalima metala su atomi vrlo blizu jedan drugome.
Dolazi do preklapanja njihovih atomskih orbitala.
Na taj način nastaju molekulske orbitale
koje se protežu kroz cijeli kristal.
Kako je broj atoma u kristalu metala vrlo velik,
velik je i broj preklapanja istovrsnih orbitala.
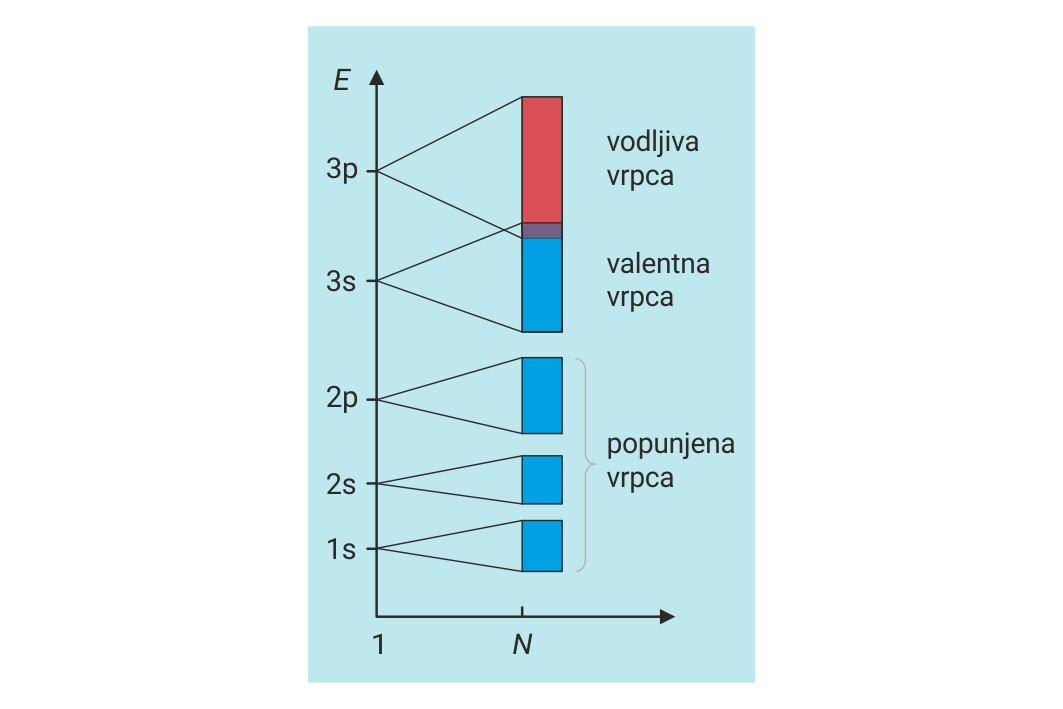
To uzrokuje nastajanje energijskih pojaseva
koje nazivamo elektronske vrpce.
Preklapanjem orbitala popunjenih unutarnjih ljusaka
nastaju popunjene vrpce.
Preklapanjem orbitala u kojima se nalaze
valentni elektroni nastaje valentna vrpca.
Preklapanjem nepopunjenih, praznih orbitala nastaje vodljiva vrpca.
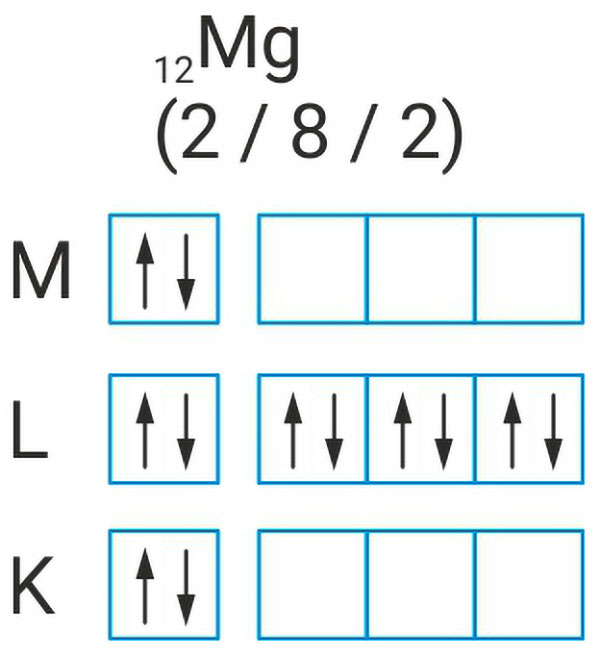
Kako nastaje metalna veza između atoma magnezija?
Elektronska konfiguracija atoma magnezija je:
Valentni se elektroni u metalu slobodno premještaju, gibaju od iona do iona.
Veza koja povezuje ione (katione) metala i elektrone elektronskog oblaka je metalna veza. Zbog suprotnih naboja pozitivnih metalnih iona i negativnih elektrona metalne veze su vrlo jake i razlog su vrlo visokih tališta i vrelišta kristala metala.
Na temelju grafikona koji prikazuje ovisnost tališta o protonskom broju metala 4. periode, možete zaključiti da vrijednosti tališta prijelaznih metala ovise o broju nesparenih elektrona u d-orbitalama njihovih atoma. Prema tome veza je jača što je broj nesparenih elektrona u atomima metala veći.
Budući da atomi cinka, kadmija i žive imaju sve d-elektrone sparene, njihova su tališta i vrelišta relativno niska. Atomi žive imaju popunjene 6s orbitale pa oni ne sudjeluju značajno u formiranju metalnih veza. Uz dodatne efekte koji se objašnjavaju složenim teorijama, to znači da među atomima žive vladaju slabe privlačne sile pa je živa, pri normalnim uvjetima, u tekućem stanju.
Teorija elektronskih vrpci
Atomi se u kristalima metala nalaze vrlo blizu jedan drugome pa dolazi do preklapanja njihovih atomskih orbitala. Na taj način nastaju molekulske orbitale koje se protežu kroz cijeli kristal.
Kako je broj atoma u kristalu metala vrlo velik, velik je i broj preklapanja istovrsnih orbitala. To uzrokuje nastajanje energijskih pojaseva koje nazivamo elektronske vrpce.
Preklapanjem orbitala popunjenih unutarnjih ljusaka nastaje popunjena vrpca.
Preklapanjem orbitala u kojima se nalaze valentni elektroni nastaje valentna vrpca, a preklapanjem nepopunjenih, praznih orbitala nastaje vodljiva vrpca.
Kako nastaje metalna veza između atoma magnezija?
Elektronska konfiguracija atoma magnezija je:
U kristalu magnezija popunjene vrpce nastaju iz 1s, 2s i 2p orbitala.
Preklapanjem 3s orbitala nastaje valentna vrpca. Preklapanjem praznih 3p orbitala nastaje vodljiva vrpca. Valentna i vodljiva vrpca u kristalu magnezija se preklapaju.
Djelovanjem vanjskog električnog polja
elektroni prelaze iz valentne u vodljivu vrpcu.
Valentna vrpca je djelomično popunjena, a vodljiva vrpca je nepopunjena.
Na taj način elektroni u metalu provode struju.
Tvari u kojima se valentna i vodljiva vrpca ne preklapaju,
a energijski razmak između njih nije velik, nazivamo poluvodiči.
Poluvodiči nisu dobri vodiči električne struje.
Veliku uporabu kao poluvodiči imaju silicij i germanij.
Tvari s velikim energijskim razmakom
između valentne i vodljive vrpce su izolatori.
Izolatori ne provode struju i toplinu.
To je zato što je za prijelaz elektrona iz valentne u vodljivu vrpcu
potrebna izuzetno velika energija.
Neki od izolatora su guma, staklo, plastika i drugi.
Djelovanjem vanjskog električnog polja elektroni prelaze iz valentne (djelomično popunjene) u vodljivu (nepopunjenu) vrpcu i na taj način elektroni u metalu provode struju.
Tvari u kojima se valentna i vodljiva vrpca ne preklapaju, a energijski razmak između njih nije velik, nazivamo poluvodiči. Poluvodiči nisu dobri vodiči električne struje. Veliku uporabu kao poluvodiči imaju silicij i germanij.
Tvari s velikim energijskim razmakom između valentne i vodljive vrpce su izolatori. Izolatori ne provode struju i toplinu jer je za prijelaz elektrona iz valentne u vodljivu vrpcu potrebna izuzetno velika energija. Neki od izolatora su guma, staklo, plastika i drugi.
Kako se poluvodičima može povećati vodljivost?
Vodljivost poluvodiča može se povećati porastom temperature.
Vodljivost silicija i germanija pri višim temperaturama je veća.
Naime, porastom temperature raste energija elektrona u valentnoj vrpci.
Na taj način elektron prelazi iz valentne u vodljivu vrpcu.
Mjesto u kristalu s kojeg je elektron otišao nazivamo šupljinom.
U tu šupljinu može ući elektron iz neke od susjednih veza.
Tada šupljina nastaje na nekom drugom mjestu.
Vodljivost poluvodiča može se povećati i
dodatkom malih količina nekih drugih atoma.
Takve poluvodiče nazivamo poluvodiči s nečistoćama.
Zamijeni li se atom silicija atomom fosfora,
tada taj elektron dodanog atoma prelazi iz valentne u vodljivu vrpcu.
Atom fosfora ima jedan valentni elektron više.
Na taj se način povećava električna vodljivost silicija.
Takvi poluvodiči nazivaju se poluvodiči n-tipa (n-negativno).
Kako se poluvodičima može povećati vodljivost?
Vodljivost poluvodiča može se povećati porastom temperature. Vodljivost silicija i germanija pri višim temperaturama je veća jer porastom temperature raste energija elektrona u valentnoj vrpci. Na taj način elektron prelazi iz valentne u vodljivu vrpcu, a mjesto u kristalu s kojeg je elektron otišao nazivamo šupljinom. U tu šupljinu može ući elektron iz neke od susjednih veza. Tada šupljina nastaje na nekom drugom mjestu.
Vodljivost poluvodiča može se povećati i dodatkom malih količina nekih drugih atoma. Takve poluvodiče nazivamo poluvodiči s nečistoćama.
Zamijeni li se atom silicija atomom fosfora, koji ima jedan valentni elektron više , tada taj elektron dodanog atoma prelazi iz valentne u vodljivu vrpcu. Na taj se način povećava električna vodljivost silicija. Takvi poluvodiči nazivaju se poluvodiči n-tipa (n-negativno).
Zamijeni li se atom silicija atomom bora, koji ima jedan valentni elektron manje od atoma silicija, on će u kristalnoj rešetki silicija povećati broj šupljina. Time se poveća električna vodljivost silicija. Takvi poluvodiči nazivaju se poluvodiči p-tipa (p-pozitivno).
Na kraju…
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji je od navedenih elemenata najbolji vodič struje?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Tvari s metalnom vezom:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja od sljedećih tvrdnji najbolje opisuje sastav strukture kristala metala?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?