Građa atoma
- navesti svojstva subatomskih čestica u atomu
- analizirati tijek i zaključke Ruthefordovog pokusa
- upotrijebiti protonski i nukleonski broj u određivanju broja subatomskih čestica i vrste atoma
Uvod
Slikovito rečeno, naš planet i mi samo smo nastali iz zvjezdane prašine.
Ugljik u našem tijelu, silicij u stijenama, kisik u zraku i vodi,
željezo u konstrukcijama mostova i nebodera
nastali su kao posljedice eksplozije zvijezda.
Tako su nastali i ostali prirodni kemijski elementi koje poznajemo.
Uvod
Naš planet, pa i mi sami nastali smo, slikovito rečeno, iz zvjezdane prašine. Naime, ugljik u našem tijelu, silicij u stijenama, kisik u zraku i u vodi, željezo u konstrukcijama mostova i nebodera diljem svijeta, kao i ostali prirodni kemijski elementi koje poznajemo, nastali su kao posljedica eksplozije zvijezda.
Kemijski elementi su tvari koje se sastoje od samo jedne vrste atoma.
Do danas je poznato 118 kemijskih elemenata.
91 element se može pronaći u prirodi, a 27 elemenata je dobiveno u znanstvenim laboratorijima.
Richard Feynman (1918-1988.) je jedan od najvećih fizičara 20.stoljeća i američki nobelovac.
On je napisao knjigu ˝Šest lakih komada˝.
U toj knjizi je postavio ovo pitanje:
„Kada bi u nekoj kataklizmi sve znanje bilo uništeno
i kada bi budućim generacijama mogli ostaviti samo jednu rečenicu,
koja bi rečenica s najmanje riječi sadržavala najviše informacija?“
Poznati nobelovac je zaključio
da bi rečenica s najviše informacija bila hipoteza o atomu.
Ta rečenica u slobodnom prijevodu glasi:
˝Atomi su osnovne građevne jedinice većine tvari.˝
Kemijski elementi su tvari koje se sastoje od samo jedne vrste atoma.
Do danas je poznato 118 kemijskih elemenata, od kojih se 91 pronalazi u prirodi. Preostalih 27 elemenata dobiveno je u znanstvenim laboratorijima.
Jedan od najvećih fizičara 20. stoljeća američki je nobelovac Richard Feynman (1918. – 1988.). On je u svojoj knjizi „Šest lakih komada“ postavio pitanje:
„Kada bi u nekoj kataklizmi sve znanje bilo uništeno i kada bi budućim generacijama mogli ostaviti samo jednu rečenicu, koja bi rečenica s najmanje riječi sadržavala najviše informacija?“
Poznati nobelovac zaključio je da je to hipoteza o atomu, odnosno rečenica, u slobodnom prijevodu: Atomi su osnovne građevne jedinice većine tvari.
Atom tijekom povijesti
Propitivanjem teorija i unaprijeđivanjem eksperimentalnih postupaka, znanstvenici su sve više stjecali znanja o atomu.
Razvojem eksperimentalne fizike otkriveno je da se atomi
ne sastoje samo od protona, neutrona i elektrona.
Otkriven je velik broj čestica koje se dijele u četiri osnovne skupine:
1.kvanti polja (fotoni)
2.leptoni
3.barioni
4.mezoni
Teoretski fizičari pretpostavljaju da će se u budućnosti
eksperimentalno potvrditi veliki broj novih čestica.
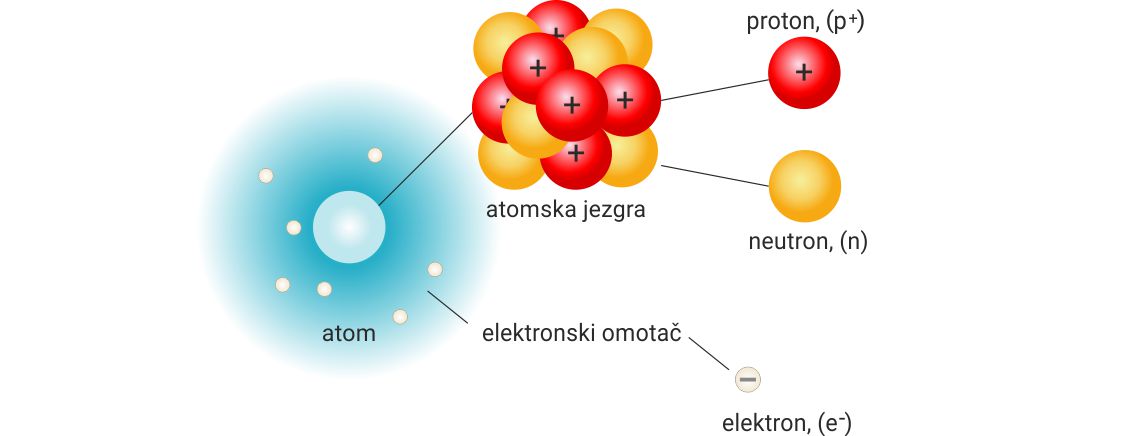
Građa atoma
pozitivno nabijene jezgre i negativno nabijenog elektronskog omotača.
Krajem 19. stoljeća i početkom 20. stoljeća došlo se do spoznaje da je
atom izgrađen od subatomskih čestica: protona, elektrona i neutrona.
Svojstva navedenih čestica su:
Proton, (p+), stabilna je subatomska čestica mase 1,673 × 10-27 kg, ima pozitivan elementarni naboj + 1,602 × 10-19 C, a nabojni broj mu je +1. Ime joj je dao E. Rutherford 1920. godine.
Neutron, (n), je neutralna subatomska čestica mase 1,675 × 10-27 kg. Nabojni broj neutrona je 0. Otkrio ga je 1932. godine J. Chadwick.
Elektron, (e–), kao subatomsku česticu otkrio je 1897. godine J. J. Thomson. Masa elektrona iznosi 9,109 × 10-31 kg i ima negativan elementarni naboj – 1,602 × 10-19 C. Nabojni broj elektrona je -1.
Razvojem eksperimentalne fizike otkriven je velik broj čestica koje se uz protone, neutrone i elektrone nalaze u atomima. Dijelimo ih u četiri osnovne skupine: kvanti polja (fotoni), leptoni, barioni i mezoni. Teorijski fizičari pretpostavljaju da će se u budućnosti eksperimentalno potvrditi veliki broj novih čestica.
Građa atoma
Prisjetite se što ste u osnovnoj školi učili o građi atoma (vidite jedinicu 3.1 Građa atoma u DOS-u Kemija 7).
Krajem 19. stoljeća i početkom 20. stoljeća došlo se do spoznaje da je atom izgrađen od subatomskih čestica: protona, elektrona i neutrona.
Svojstva navedenih čestica su:
Proton, (p+), stabilna je subatomska čestica mase 1,673 × 10-27 kg, ima pozitivan elementarni naboj + 1,602 × 10-19 C, a nabojni broj mu je +1. Ime joj je dao E. Rutherford 1920. godine.
Neutron, (n), je neutralna subatomska čestica mase 1,675 × 10-27 kg. Nabojni broj neutrona je 0. Otkrio ga je 1932. godine J. Chadwick.
Elektron, (e–), kao subatomsku česticu otkrio je 1897. godine J. J. Thomson. Masa elektrona iznosi 9,109 × 10-31 kg i ima negativan elementarni naboj – 1,602 × 10-19 C. Nabojni broj elektrona je -1.
Elementarni se naboj označava slovom e. Vrijednost elementarnog naboja utvrđena je eksperimentalnim putem.
z = nabojni broj
Q = električni naboj
e = elementarni naboj, e= 1,602 × 10-19 C
Nabojni broj električki nabijene čestice određen je omjerom naboja te čestice, Q, i elementarnog naboja, e, a označuje se slovom z.
Rutherfordov pokus
Početkom dvadesetog stoljeća dokazano je
da atomi nisu nedjeljive čestice.
Nakon tog otkrića, počelo se intenzivnije proučavati građu atoma.
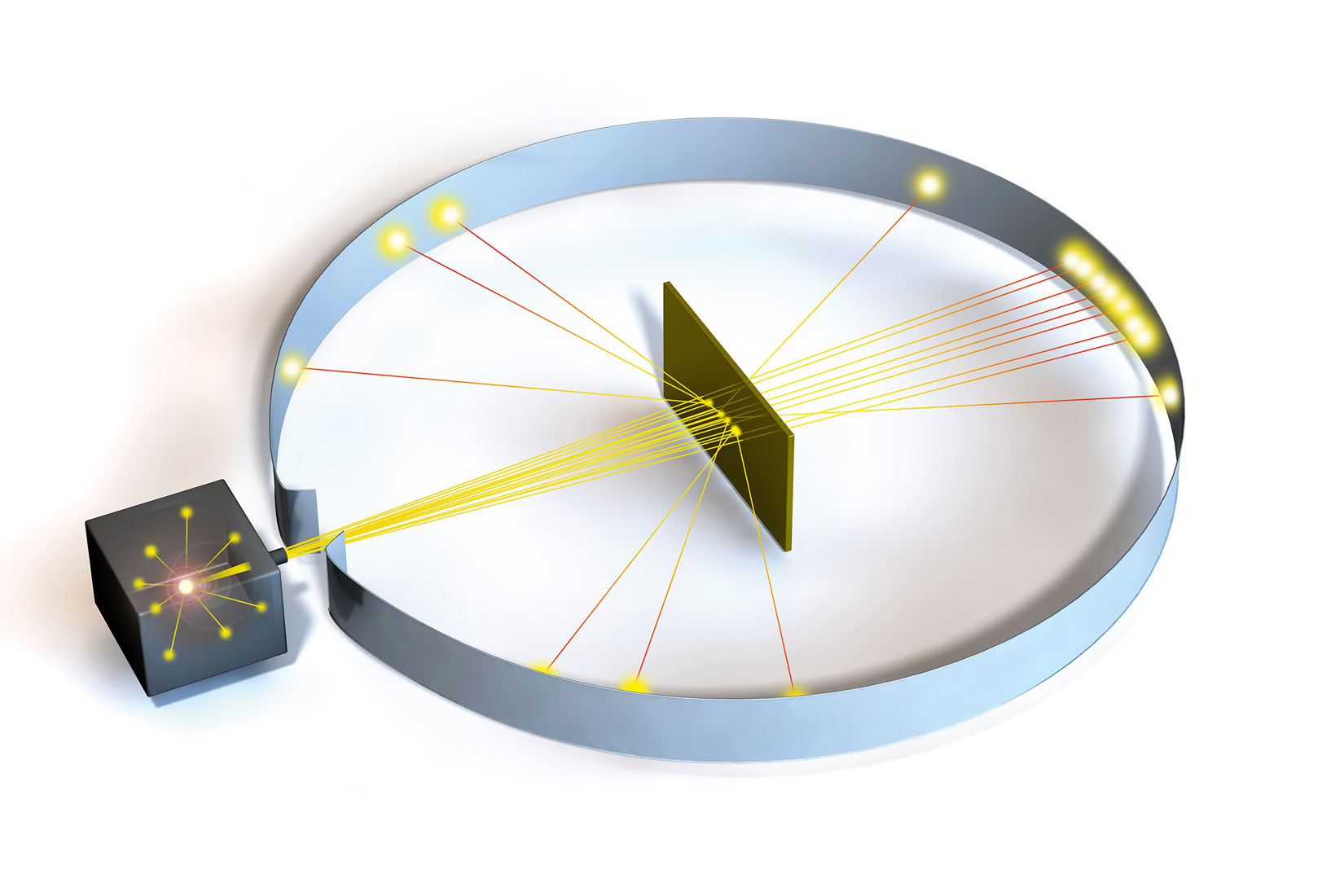
Osnovne spoznaje o građi atoma dao je Ernest Rutherford.
Tijekom 1909. sa svojim suradnicima je načinio niz pokusa.
U tim pokusima je istraživao prolazak α-čestica (jezgre helijevih atoma)
kroz vrlo tanak listić zlata.
Najveći broj α-čestica čestica je prošao kroz listić zlata.
Dio α-čestica je skrenuo s pravocrtnog puta.
Neke α-čestice su se vratile natrag.
To vraćanje α-čestica je iznenadilo istraživače.
Elementarni se naboj označava slovom e. Vrijednost elementarnog naboja utvrđena je eksperimentalnim putem.
z = nabojni broj
Q = električni naboj
e = elementarni naboj, e= 1,602 × 10-19 C
Nabojni broj električki nabijene čestice određen je omjerom naboja te čestice, Q, i elementarnog naboja, e, a označuje se slovom z.
Rutherfordov pokus
Nakon što je početkom dvadesetog stoljeća dokazano da atomi nisu nedjeljive čestice (otkriće radioaktivnosti) počelo se intenzivnije proučavati građu atoma.
Osnovne spoznaje o građi atoma dao je Ernest Rutherford. Tijekom 1909. godine on je sa svojim suradnicima načinio niz pokusa istražujući prolazak α-čestica (jezgre helijevih atoma) kroz vrlo tanki listić zlata. Najveći je broj α-čestica prošao kroz taj listić, dio njih je skrenuo s pravocrtnog puta, a poneke α-čestice su se, na veliko iznenađenje istraživača, vratile natrag.
Temeljem tog pokusa Rutherford je izradio fizički model atoma.
Rutherford je zaključio da su naboj i masa atoma
koncentrirani u njegovom središtu.
Do tog zaključka je došao zbog odbijanja
malog broja α-čestica od listić zlata
i otklona pojedinih α-čestica od pravocrtne putanje.
Središte atoma je kasnije nazvano jezgrom.
Najveći broj α-čestica je bez prepreka prošao kroz listić zlata.
Rutherford je zaključio da je atom najvećim dijelom prazan prostor.
Pretpostavio je da se u tom prostoru samo nalaze male,
negativno nabijene čestice, zanemarive mase.
Zahvaljujući (i) Ruthefordu, danas znamo da je atom sastavljen od
pozitivno nabijene jezgre i elektronskog omotača u kojem se gibaju negativno nabijeni elektroni.
Iako je masa atoma gotovo jednaka masi atomske jezgre,
jezgra zauzima jako mali dio volumena atoma.
Promjer jezgre iznosi od 10–15 m do 10–14 m.
Približan promjer atoma je 10–10 m.
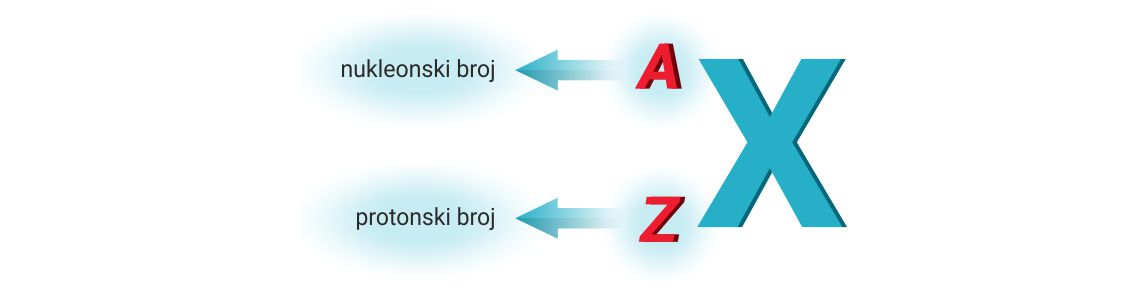
Protonski i nukleonski broj
Broj
protonskim brojem i označuje slovom, Z.
Budući da je atom neutralna čestica,
broj protona i elektrona u atomu je jednak.
Uz broj protona u atomu, protonski broj označava i broj elektrona.
Z = N(p+) = N(e–)
Osim protonskim brojem, Z, atom je određen i nukleonskim brojem, A.
Nukleonski broj, A, jednak je ukupnom broju nukleona (protona i neutron) u jezgri.
A= N(p+) + N(n)
Protonski broj, Z, piše se uz simbol kemijskog elementa, kao lijevi donji indeks, a nukleonski broj, A, kao lijevi gornji indeks.
Temeljem tog pokusa Rutherford je izradio fizički model atoma. Odbijanje malog broja α-čestica od listića zlata i otklon pojedinih α-čestica od pravocrtne putanje Rutheforda je navelo na zaključak da su naboj i masa atoma koncentrirani u njegovom središtu. To je središte kasnije nazvano jezgrom atoma.
S obzirom da je najveći broj α-čestica bez prepreka prošao kroz listić zlata, zaključio je da je atom najvećim dijelom prazan prostor. U tom se prostoru, pretpostavio je, nalaze samo male, negativno nabijene čestice zanemarive mase.
Zahvaljujući (i) Ruthefordu danas znamo da je atom sastavljen od pozitivno nabijene jezgre i elektronskog omotača u kojem se gibaju negativno nabijeni elektroni.
Iako je masa atoma gotovo jednaka masi atomske jezgre, jezgra zauzima jako mali dio volumena atoma. Naime, promjer jezgre iznosi od 10-15 m do 10-14 m, dok je približan promjer atoma 10-10 m.
Protonski i nukleonski broj
Broj
Osim protonskim brojem, Z, atom je određen i nukleonskim brojem, A. Nukleonski broj, A, jednak je ukupnom broju nukleona (protona i neutrona) u jezgri.
Protonski broj, Z, piše se uz simbol kemijskog elementa, kao lijevi donji indeks, a nukleonski broj, A, kao lijevi gornji indeks.
Svi atomi istog protonskog broja čine kemijski element.
Riješite zadatke:
1. Koliki je naboj jezgre, QN, atoma natrija iskazan u coulombima?
2. Koliko iznosi naboj jezgre atoma bakra izražen u coulombima?
Rješenja zadataka:
1. zadatak
2. zadatak
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Veličina i masa atoma
Atomi su vrlo sitne čestice, malog polumjera (ra ) i vrlo male mase (ma).
Primjerice, tako je polumjer atoma vodika, , 37,3 pm, a polumjer atoma cezija, , je 265,5 pm.
Prilikom očitavanja tako napisanih brojeva lako je pogriješiti. Zbog toga ih pišemo u obliku znanstvenog zapisa. Znanstvenim zapisom broj pišemo kao umnožak decimalnog broja manjeg od 10 i odgovarajuće potencije broja 10.
Osim malih polumjera i mase atoma su vrlo male. Primjerice, masa atoma vodika je:
, odnosno .
Masa atoma cezija je:
, odnosno
.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Gustoća jezgre atoma iznosi . Iskažite tu vrijednost u gramima po kubičnom centimetru.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Završetak
Osmislite i uključite se u istraživački miniprojekt.
Podijelite se u skupine.
Istražite povijesni razvoj ideje o građi atoma.
Pretražite mrežne stranice po ključnim pojmovima:
atom,razvoj spoznaja o građi atoma,
suvremene teorije o građi atoma i sl.
Unutar skupine načinite mentalnu mapu u alatu Xmind .
Na taj način usustavite ključne pojmove
povezane s razvojem ideje o građi atoma.
Ključni pojmovi koje treba usustaviti su:
jezgra, električni omotač, elektron,
proton,neutron,nukleoni,nabojni broj: -1, nabojni broj: +1 itd.
Svoje uratke predstavite suučenicima u razredu.
Izaberite najkreativniju i najbolje usustavljenu mentalnu mapu.
Ne zaboravite istražiti i umetnuti u mentalnu mapu i
neke zanimljivosti iz života i rada Ruđera Boškovića.
Na temelju istraživačkog miniprojekta, radom u skupinama, istražite povijesni razvoj ideje o građi atoma. Pretražite mrežne stranice po ključnim pojmovima, npr. atom, razvoj spoznaja o građi atoma, suvremene teorije građe atoma i sl. Unutar skupine u alatu Xmind načinite mentalnu mapu i na taj način usustavite ključne pojmove povezane s razvojem ideje o građi atoma (jezgra, elektronski omotač, elektron, proton, neutron, nukleoni, nabojni broj: -1, nabojni broj: +1, itd.)
Svoje uratke predstavite suučenicima u razredu. Izaberite najkreativniju i najbolje usustavljenu mentalnu mapu. Ne zaboravite istražiti i umetnuti u mentalnu mapu i neke zanimljivosti iz života i rada Ruđera Boškovića.
Na kraju…
Riješite interaktivni kviz!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Tvorcem ideje o atomu smatra se:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Smatrao je da su atomi točke, čestice bez dimenzija. Među točkama djeluju privlačne i odbojne sile, pri čemu na malim udaljenostima prevladavaju odbojne, a na većim udaljenostima privlačne sile između kojih se uspostavlja ravnoteža. Bio je genijalan i svestran um svoga vremena. On je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliki je broj atoma srebra koji stane na duljinu od 25,0 cm ako je polumjer atoma srebra 144,5 pm.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliko nukleona ima atom rubidija, Rb s nukleonskim brojem 85.
Želite li pokušati ponovo?