Periodičnost svojstava elemenata
- predvidjeti kako se mijenjaju polumjer, energija ionizacije i elektronski afinitet atoma elemenata u skupini i kroz periode PSE-a
Uvod
Kemijski elementi pokazuju periodičnost svojih svojstava koja se može objasniti njihovom elektronskom konfiguracijom. Pogledajte sljedeće videozapise i potom donesite zaključke o reaktivnosti alkalijskih metala.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Na temelju reakcije litija, natrija i kalija s vodom zaključujemo da su navedeni alaklijski metali:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Označite koji je od navedenih alaklijskih metala najreaktivniji (najburnije je reagirao s vodom):
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Produkti u reakciji navedenih alkalijskih metala s vodom su:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Temeljem reakcije željeza s halogenim elementima, klorom i bromom, zaključujemo da su halogeni elementi:
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Zabilježite zapažanja i napišite jednadžbe kemijskih reakcija željeza
s halogenim elementima, klorom i bromom, služeći se alatom
Pisanje kemijskih jednadžbi na webu
Halogeni elementi su elementi 17. skupine PSE-a.
Vro su reaktivni.
Zbog toga se ne javljaju u prirodi u elementarnom stanju.
Porastom protonskog broja kroz skupinu smanjuje im se reaktivnost.
Periodičnost fizikalnih svojstava
Periodičnost svojstava temelj je
svrstavanja elemenata u tablicu periodnog sustava.
Kako se mijenja atomski polumjer, energija ionizacije
i elektronski afinitet duž perioda
i skupina periodnoga sustava elemenata?
Atomski polumjer
Atomi su kuglastog oblika pa je polumjer
pojam koji opisuje njihovu veličinu.
Napišite jednadžbe kemijskih reakcija željeza s halogenim elementima, klorom i bromom, služeći se alatom Pisanje kemijskih jednadžbi na webu.
Halogeni elementi su elementi 17. skupine PSE-a. Vrlo su reaktivni pa se u prirodi ne javljaju u elementarnom stanju. Porastom protonskog broja kroz skupinu smanjuje im se reaktivnost.
Periodičnost fizikalnih svojstava
Periodičnost svojstava temelj je svrstavanja elemenata u tablicu periodnog sustava. Kako se mijenja atomski polumjer, energija ionizacije i elektronski afinitet duž perioda i skupina periodnoga sustava elemenata?
Atomski polumjer
Atomi su kuglastog oblika pa je polumjer pojam koji opisuje njihovu veličinu.
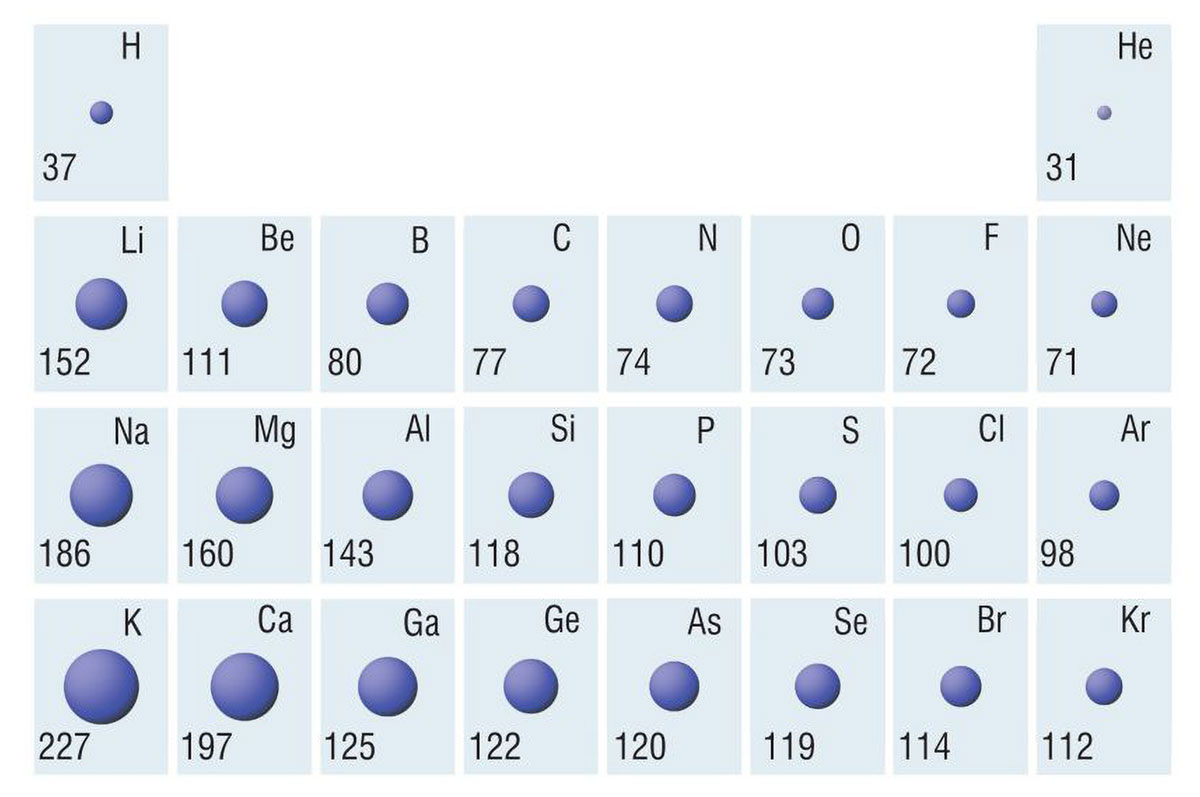
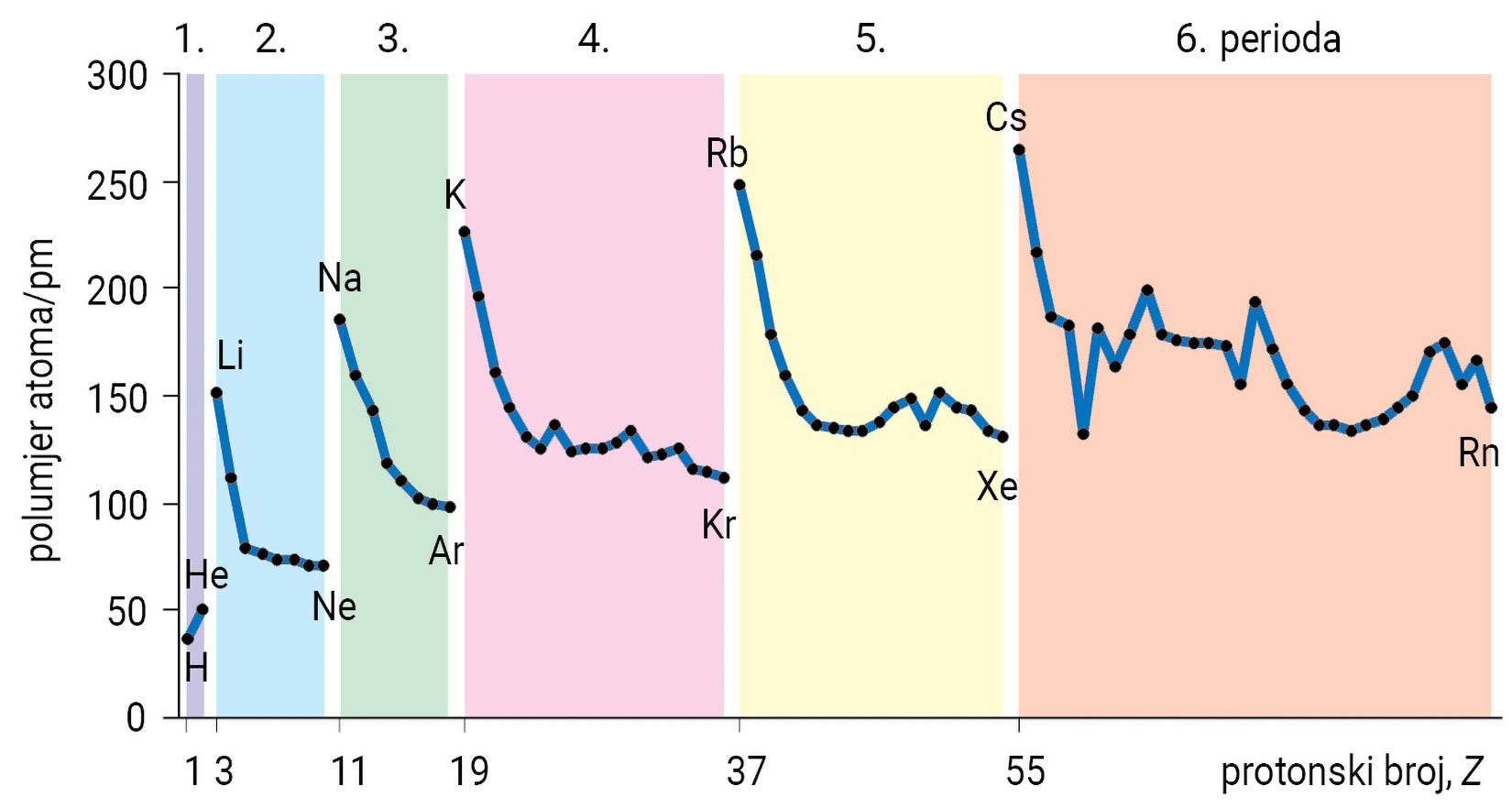
Na slici su prikazane vrijednosti atomskih polumjera atoma, ra, u prve četiri periode s– i p-bloka iskazane u pikometrima.
Možemo li iz položaja u periodnom sustavu elemenata zaključiti koji atom ima najmanji, a koji najveći polumjer?
Proučite dijagram i odgovorite kako se mijenja polumjer atoma unutar skupine, a kako unutar periode?
Porastom protonskog broja unutar jedne periode
raste naboj jezgre i naboj elektronskog omotača.
Porastom naboja, privlačna sila između jezgre
i elektrona postaje sve jača.
Zbog toga se smanjuje polumjer atoma.
Polumjeri atoma u periodi smanjuju se porastom protonskog broja.
Porastom protonskog broja unutar jedne skupine raste broja ljusaka.
Zbog toga raste i polumjer atoma.
Porastom protonskog broja unutar jedne periode raste naboj jezgre i naboj elektronskog omotača. Porastom naboja, privlačna sila između jezgre i elektrona postaje sve jača, zbog čega se smanjuje polumjer atoma. Polumjeri atoma u periodi, dakle, smanjuju se porastom protonskog broja.
Porastom protonskog broja unutar jedne skupine raste broja ljusaka, prema tome raste i polumjer atoma.
Energija ionizacije
Energija koju je potrebno dovesti izoliranom atomu
ili ionu neke tvari u plinovitom stanju
za uklanjanje jednog elektrona naziva se energija ionizacije.
Energiju potrebnu za uklanjanje prvog elektrona
iz električki nenabijene čestice
nazivamo prvom energijom ionizacije, Ei(1).
Za uklanjanje drugog elektrona iz omotača iste čestice
potrebno je utrošiti veću energiju.
Tu energiju nazivamo drugom energijom ionizacije, Ei(2).
Mjerna jedinica za energiju ionizacije je
kJ/mol ili elektronvolt (1 eV = 1,602 x 10-19 J).
Pozitivno nabijenoj čestici teže oduzeti elektron nego neutralnoj.
Zato je druga energija ionizacije uvijek veća od prve, Ei(2) > Ei(1).
X(g) → X + (g) + e– Ei(1)
X + (g) → X2 + (g) + e– Ei(2)
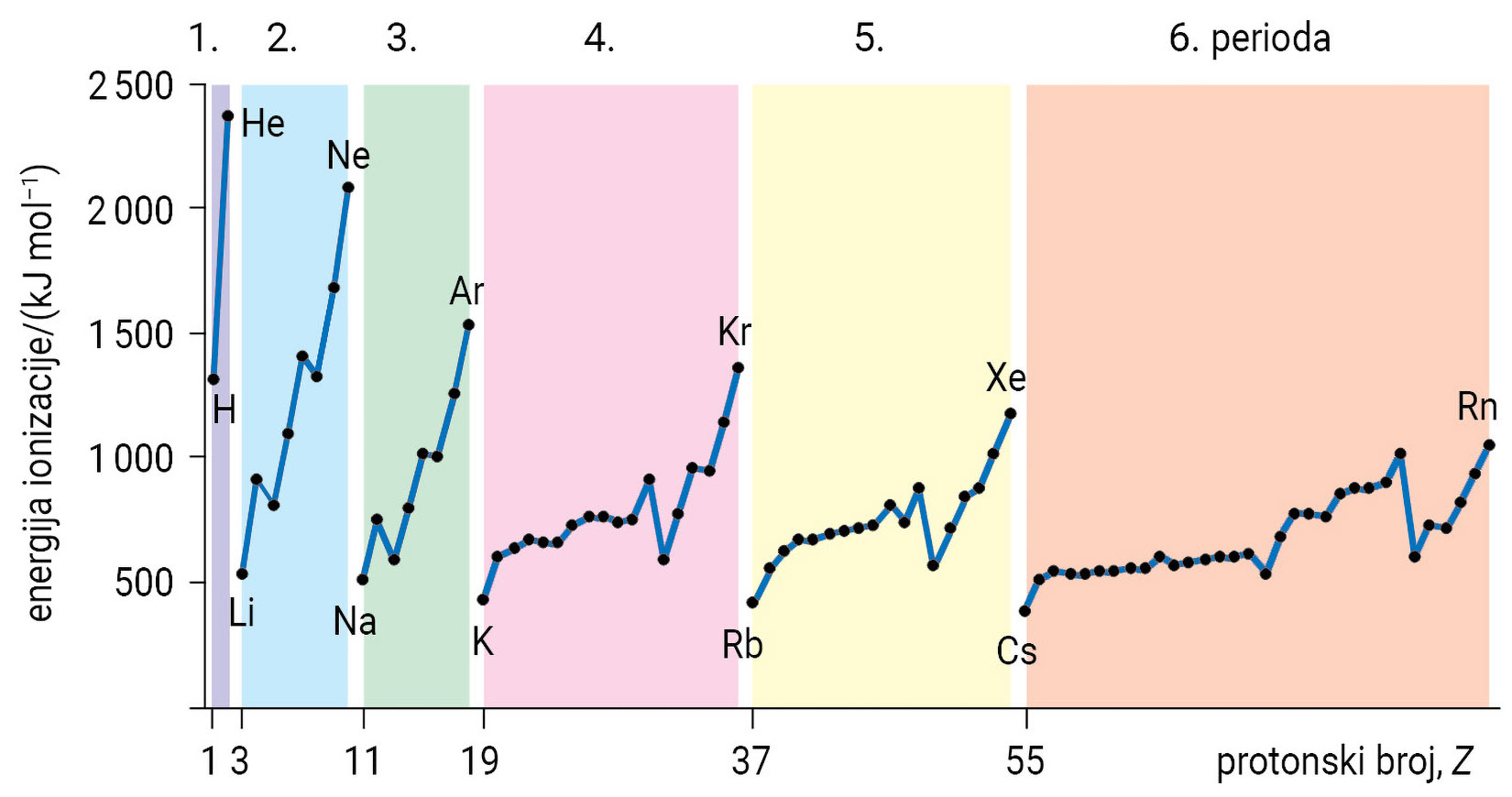
Proučite dijagram i odgovorite na pitanje.
Kako se mijenja energija ionizacije unutar skupine, a kako unutar periode?
Energija ionizacije
Energija koju je potrebno dovesti izoliranom atomu ili ionu neke tvari u plinovitom stanju za uklanjanje jednog elektrona naziva se energija ionizacije. Energiju potrebnu za uklanjanje prvog elektrona iz električki nenabijene čestice nazivamo prvom energijom ionizacije, . Za uklanjanje drugog elektrona iz omotača iste čestice potrebno je utrošiti veću energiju. Tu energiju nazivamo drugom energijom ionizacije, . Mjerna jedinica za energiju ionizacije je ili elektronvolt
(). Budući da je pozitivno nabijenoj čestici teže oduzeti elektron nego neutralnoj, druga je energija ionizacije uvijek veća od prve, .
Proučite dijagram i odgovorite kako se mijenja energija ionizacije unutar skupine, a kako unutar periode?
Porastom protonskog broja kroz skupinu povećava se udaljenost valentnih elektrona od jezgre, pa se smanjuje privlačna sila između jezgre i valentnih elektrona. Zbog toga je za uklanjanje sve udaljenijih valentnih elektrona potrebna manja energija.
Porastom protonskog broja kroz periodu raste broj protona u jezgri i elektrona u elektronskom omotaču. Porastom naboja jezgre raste i privlačna sila između jezgre i elektrona, pa je elektrone sve teže ukloniti iz atoma. Energija ionizacije raste unutar periode od 1. do 18. skupine.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Uklanjanje elektrona iz atoma ili iona je:
Želite li pokušati ponovo?
Navedene su energije ionizacije atoma litija:
Odgovorite na pitanja:
- Zašto prva energija ionizacije, , atoma litija, ima najmanju vrijednost?
- U kojoj se orbitali atoma litija nalaze valentni elektroni?
- Zašto atom litija ima tri energije ionizacije?
- Vrijednosti i atoma litija se jako razlikuju. Zašto?
Odgovori na pitanja:
- atoma litija ima najmanju vrijednost jer je za udaljavanje prvoga elektrona iz električki neutralne čestice potrebno dovesti najmanje energije.
- Valentni elektron atama litija nalazi se u s-orbitali.
- Atom litija ima tri elektrona pa zbog toga ima i tri energije ionizacije.
- Između atoma litija je jako velika razlika, jer je pozitivno nabijenoj čestici teže oduzeti elektron nego neutralnoj.
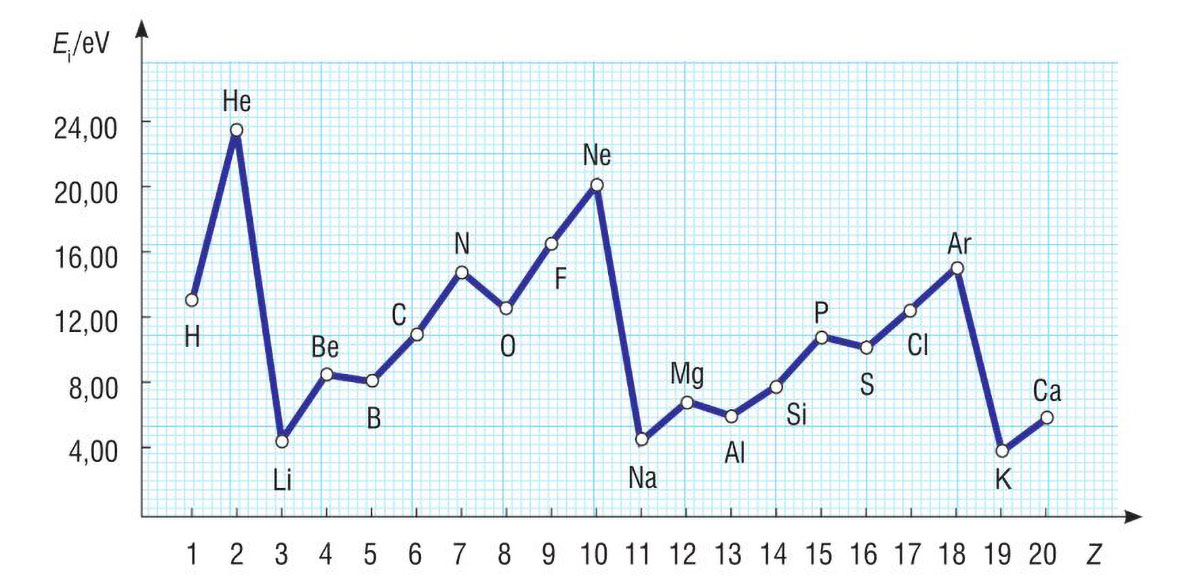
Na temelju dijagrama odredite koji elementi pokazuju odstupanja u porastu energije ionizacije.
Odstupanja u porastu energije ionizacije pokazuju
bor, kisik, aluminij i sumpor.
Elektronska konfiguracija sa sparenim s-elektronima
stabilnija je od konfiguracije s jednim
nesparenim elektronom u p-orbitali.
Zbog toga su energije ionizacije berilija i magnezija
veće od energija ionizacije bora i aluminija.
Također, stabilnija je konfiguracija atoma
s nesparenim elektronima p-podljuske
od konfiguracije s djelomično sparenim elektronima.
Zbog toga su energije ionizacije dušika i fosfora
(s tri nesparena elektrona) veće od energija ionizacije kisika i sumpora.
Afinitet prema elektronu
Atomi nemetala primanjem elektrona
oslobađaju više energije od atoma metala.
Time postižu energetski povoljniju konfiguraciju plemenitog plina.
U težnji postizanja energijski stabilnijeg stanja
atomi različitih elemenata pokazuju različiti afinitet za elektronom.
Afinitet za elektronom je tendencija atoma
za privlačenjem dodatnog elektrona.
To je eksperimentalno mjerljiva vrijednost.
Tu vrijednost definiramo kao količinu energije
koju atom ili molekula tvari u plinovitom stanju
oslobodi ili veže prilikom primanja elektrona.
Pri tome nastaje negativni ion.
Nemetali imaju velik elektronski afinitet i lako tvore negativne ione.
X(g) + e–→ X–(g)
X–(g) + e–→X2–(g)
Porastom protonskog broja afinitet prema elektronu
povećava se unutar periode, a smanjuje unutar skupine.
Na temelju dijagrama odredite koji elementi pokazuju odstupanja u porastu energije ionizacije?
Odstupanja u porastu energije ionizacije pokazuju bor, kisik, aluminij i sumpor.
Elektronska konfiguracija sa sparenim s-elektronima stabilnija je od konfiguracije s jednim nesparenim elektronom u p-orbitali. Zbog toga su energije ionizacije berilija i magnezija veće od energija ionizacije bora i aluminija. Također, stabilnija je konfiguracija atoma s nesparenim elektronima p-podljuske od konfiguracije s djelomično sparenim elektronima. Zbog toga su energije ionizacije dušika i fosfora (s tri nesparena elektrona) veće od energija ionizacije kisika i sumpora.
Afinitet prema elektronu
Atomi nemetala primanjem elektrona oslobađaju više energije od atoma metala. Time postižu energetski povoljniju konfiguraciju plemenitog plina. U težnji postizanja energijski stabilnijeg stanja atomi različitih elemenata pokazuju različiti afinitet za elektronom. Afinitet za elektronom je, dakle, tendencija atoma za privlačenjem dodatnog elektrona. To je eksperimentalno mjerljiva vrijednost. Definiramo je kao količinu energije koju atom ili molekula tvari u plinovitom stanju oslobodi ili veže prilikom primanja elektrona. Pri tome nastaje negativni ion. Nemetali imaju velik elektronski afinitet i lako tvore negativne ione.
Porastom protonskog broja afinitet prema elektronu se povećava unutar periode, a smanjuje unutar skupine.
Na kraju…
Riješite interaktivni kviz!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji je od navedenih kemijskih elemenata najreaktivniji?
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
U kojim se od navedenih nizova elemenata smanjuje polumjer atoma?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Prva energija ionizacije:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji od elemenata, čiji atomi imaju navedene elektronske konfiguracije, ima najjače izražena metalna svojstva?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Najpozitivnije (najviše) vrijednosti elektronskog afiniteta u periodnom sustavu elemenata imaju:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji od elemenata, čiji atomi imaju navedene elektronske konfiguracije, ima najviši (najpozitivniji) afinitet prema elektronu?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koliko elektrona u valentnoj ljuski ima atom kojeg su prvih pet energija ionizacije:
Želite li pokušati ponovo?