Periodni sustav elemenata
- usporediti suvremeni periodni sustav elemenata (PSE) i Mendeljejevljevu tablicu
- procijeniti građu atoma nekoga elementa prema položaju u PSE-u
- utvrditi broj elektrona i elektronsku konfiguraciju valentne ljuske atoma elementa prema položaju u PSE-u
Uvod
Budući da su u današnje vrijeme otkrića novih kemijskih elemenata vrlo rijetka, svako novo otkriće izaziva veliku pozornost.
Novo otkrivenih elemenata nema u prirodi, stvoreni su umjetno u istraživačkim laboratorijima u strogo kontroliranim uvjetima. Četiri elementa s protonskim brojevima 113, 115, 117 i 118 popunili su do kraja 7 periodu PSE-a.
Oni su prvotno dobili ime po rednom broju ununtrij, ununpentij, ununseptij i ununoktij. Početkom prosinca 2016. godine Međunarodna organizacija za čistu i primjenjenu kemiju (IUPAC) službeno je uvrstila nova imena za navedene kemijske elemente.
Nova imena kemijskih elemenata su:
- Nihonij (Nh) za element ununtrij
- Moskovij (Mc) za element ununpentij
- Tenesin (Ts) za element ununseptij
- Oganeson (Og) za element ununoktij.
Imena za novootkrivene kemijske elemente
predložili su znanstvenici koji su ih otkrili.
Prva tri kemijska elementa dobila su ime prema
mjestu istraživačkog laboratorija u kojima su otkriveni.
Tako je Nihonij otkriven u Japanu.
Japanska riječ za Japan je Nippon ili Nihon.
Moskovij je otkriven u Moskvi i Tenesin
u američkoj saveznoj državi Tennessee.
Oganeson je dobio ime u čast ruskog znanstvenika
profesora nuklearne fizike Jurja Oganessiana.
Sva četiri novootkrivena elementa izrazito su nestabilna.
Nestabilni su zbog vrlo velikog broja protona u njihovim jezgrama.
Traju vrlo kratko, njihov životni vijek mjeri se u milisekundama.
Hoće li, u budućnosti, novootkriveni elementi
naći svoje mjesto u osmoj periodi?
Otkriće periodnog sustava elemenata
Otkriće većeg broja kemijskih elemenata
dovelo je do različitih pokušaja svrstavanja i uređivanja
tablica elemenata krajem 18. i početkom 19. stoljeća.
Najveće zasluge za otkriće periodnog sustava elemenata
pripadaju D. I. Mendeljejevu.
On je uočio da se svojstva elemenata
periodički ponavljaju nakon određenog broja elemenata.
Mendeljejev je iz navedenog zaključio da niz tada treba prekinuti,
a elemente sličnih fizikalnih i kemijskih svojstava
staviti jedan ispod drugoga.
Kad je 1869. godine D. I. Mendeljejev
objavio tablicu periodnog sustava elemenata
bila su poznata svega 63 kemijska elementa.
Za neke neotkrivene elemente ostavio je prazna mjesta.
Također, predvidio je svojstva elementa
i nekih njegovih spojeva koji će kad bude otkriven doći na to mjesto.
Nova imena kemijskih elemenata su:
- Nihonij (Nh) za element ununtrij
- Moskovij (Mc) za element ununpentij
- Tenesin (Ts) za element ununseptij
- Oganeson (Og) za element ununoktij.
Imena za novootkrivene kemijske elemente predložili su znanstvenici koji su ih otkrili. Prva tri kemijska elementa dobila su ime prema mjestu istraživačkog laboratorija u kojima su otkriveni. Tako je Nihonij otkriven u Japanu (japanska riječ za Japan je Nippon ili Nihon), Moskovij (Moskva) i Tenesin (američka savezna država Tennessee). Oganeson je dobio ime u čast ruskog znanstvenika profesora nuklearne fizike Jurja Oganessiana.
Sva četiri novootkrivena elementa izrazito su nestabilna zbog vrlo velikog broja protona u njihovim jezgrama. Traju vrlo kratko, njihov životni vijek mjeri se u milisekundama.
Hoće li, u budućnosti, novootkriveni elementi naći svoje mjesto u osmoj periodi?
Otkriće periodnog sustava elemenata
Otkriće većeg broja kemijskih elemenata dovelo je krajem 18. i početkom 19. stoljeća do različitih pokušaja svrstavanja i uređivanja tablica elemenata. Najveće zasluge za otkriće periodnog sustava elemenata pripadaju D. I. Mendeljejevu. On je uočio da se svojstva elemenata periodički ponavljaju nakon određenog broja elemenata. Iz navedenog je zaključio je da niz tada treba prekinuti a elemente sličnih fizikalnih i kemijskih svojstava staviti jedan ispod drugoga. Kad je 1869. godine D. I. Mendeljejev objavio tablicu periodnog sustava elemenata bila su poznata svega 63 kemijska elementa. Za neke neotkrivene elemente ostavio je prazna mjesta i predvidio ne samo njihova svojstva nego i neka svojstva njihovih spojeva.
Istraživački miniprojekt
Istražite povijesni razvoj ideje o periodnom sustavu elemenata.
Radite u skupinama.
U alatu Tiki-Toki izradite lentu vremena.
Na lenti kronološki prikažite znanstvenike
koji su svojim radom doprinijeli razvoju ideje
i uspostavljanju suvremenog periodnog sustava elemenata.
Neka svaka skupina predstavi svoje uratke suučenicima u razredu.
Izaberite najkreativniju i najbolje usustavljenu lentu vremena.
Zu lentu podijelite sa suučenicima u razredu i koristite ju za daljnji rad.
Kao izvor možete koristiti mrežnu stranicu:
Povijest periodnog sustava kemijskih elemenata
(Generalić, Eni. “Povijest periodnog sustava kemijskih elemenata.”
EniG. Periodni sustav elemenata. KTF-Split, 29 May 2017. Web. 13 Aug. 2017.)
Dostupno na: poveznici[25.8.2017.]
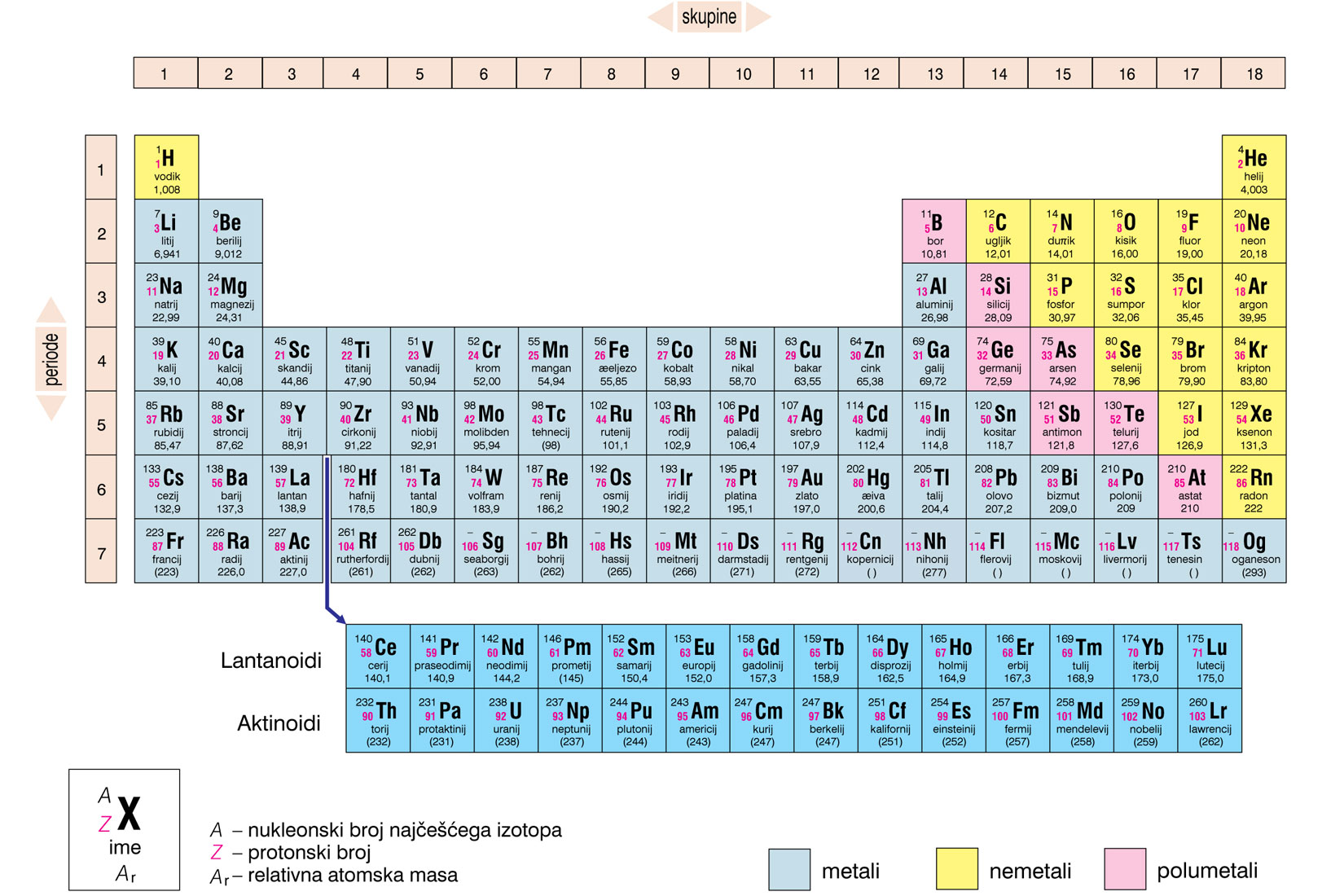
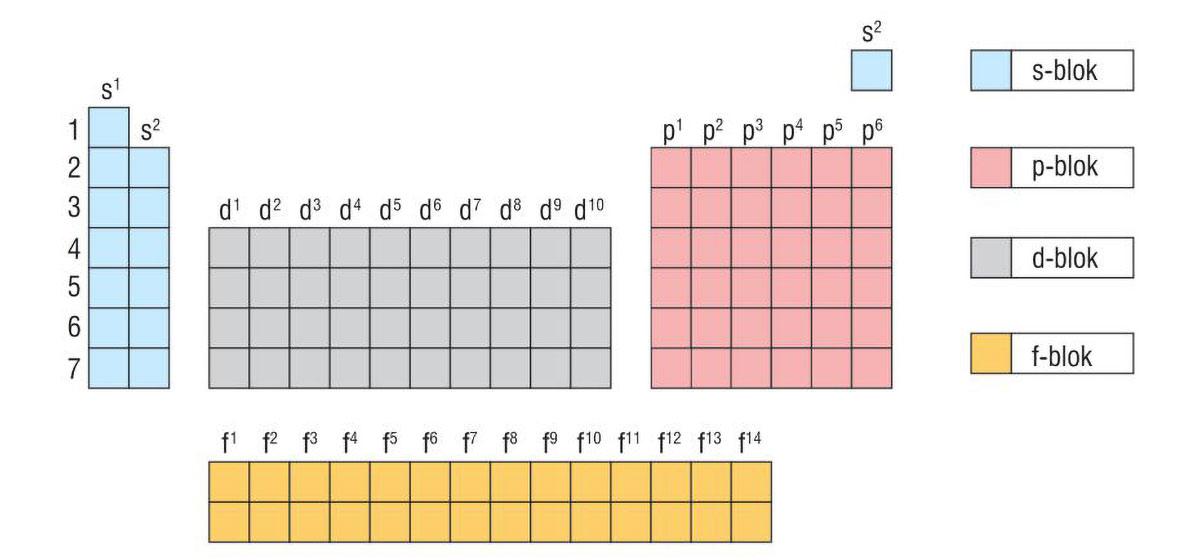
Suvremeni periodni sustav
Periodni sustav elemenata tablični je prikaz kemijskih elemenata.
Periodni sustav elemenata je organiziran
prema njihovom protonskom broju,elektronskoj konfiguraciji
i ponavljajućim svojstvima.
Svaki je element u periodnom sustavu označen simbolom.
Uz simbol je navedena prosječna
relativna atomska masa i protonski broj.
Periodni se sustav elemenata sastoji od 7 perioda (vodoravni redovi)
i 18 skupina (uspravni stupci).
Istraživački miniprojekt
Radom u skupinama, istražite povijesni razvoj ideje o periodnom sustavu elemenata, tako što ćete u alatu Tiki-Toki izraditi lentu vremena s kronološkim prikazom znanstvenika koji su svojim radom doprinijeli razvoju ideje i uspostavljanju suvremenog periodnog sustava elemenata. Svaka skupina neka svoje uratke predstavi suučenicima u razredu. Izaberite najkreativniju i najbolje usustavljenu lentu vremena pa je podijelite sa suučenicima u razredu i koristite u daljnjem radu.
Kao izvor možete koristiti mrežnu stranicu Povijest periodnog sustava kemijskih elemenata. Generalić, Eni. Periodni sustav elemenata [online]. EniG, Split: Kemijsko-tehnološki fakultet. Dostupno na: poveznici[25.8.2017.]
Suvremeni periodni sustav
Periodni sustav elemenata tablični je prikaz kemijskih elemenata organiziran prema njihovom protonskom broju, elektronskoj konfiguraciji i ponavljajućim svojstvima. Svaki je element u periodnom sustavu označen simbolom uz koji je navedena prosječna relativna atomska masa i protonski broj. Periodni se sustav elemenata sastoji od 7 perioda (vodoravni redovi) i 18 skupina (uspravni stupci).
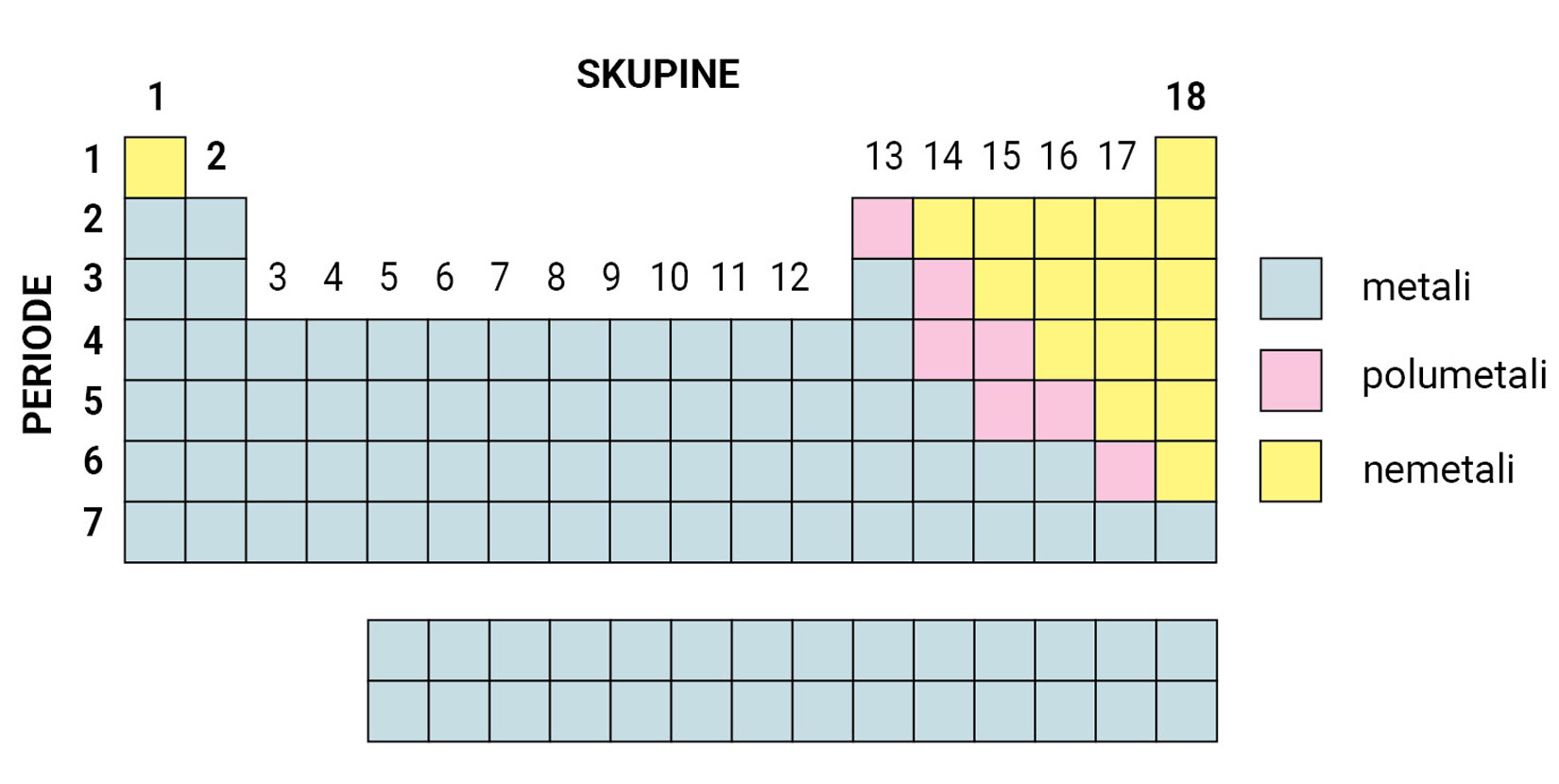
Unutar periodnog sustava elemente dijelimo na metale ili kovine koji se nalaze na lijevoj strani i u sredini periodnog sustava, na nemetale ili nekovine na desnoj strani periodnog sustava i polumetale ili polukovine koji su smješteni na granici između metala i nemetala.
Istražite i proučite sadržaje o kemijskim elementima u digitalnoj inačici periodnog sustava elemenata dostupnoj na mrežnoj stranici http://ed.ted.com/periodic-videos
Položaj elemenata u periodnom sustavu ovisi o građi atoma
Periodni sustav elemenata ima sedam perioda.
Toliko ima i energetskih razina
u elektronskom omotaču atoma najtežih elemenata.
Svaka PERIODA, osim prve, počinje
alkalijskim metalom, a završava plemenitim plinom.
Nova perioda u periodnom sustavu elemenata uvijek počinje
onda kad se u elektronskoj konfiguraciji atoma počinje
popunjavati nova ljuska (pravilo dijagonala).
Duž jedne periode svojstva elemenata se znakovito mijenjaju
upravo zbog različitoga broja elektrona u valentnoj ljuski.
Atomi svih elemenata koji se nalaze u istoj periodi imaju isti broj ljusaka.
Istražite i proučite sadržaje o kemijskim elementima u digitalnoj inačici periodnog sustava elemenata dostupnoj na mrežnoj stranici EdTED.
Položaj elemenata u periodnom sustavu ovisi o građi atoma
Periodni sustav elemenata ima sedam perioda, a toliko ima i energetskih razina u elektronskom omotaču atoma najtežih elemenata. Svaka PERIODA, osim prve, počinje alkalijskim metalom, a završava plemenitim plinom. Nova perioda u periodnom sustavu elemenata uvijek počinje onda kad se u elektronskoj konfiguraciji atoma počinje popunjavati nova ljuska (pravilo dijagonala). Duž jedne periode svojstva elemenata se znakovito mijenjaju upravo zbog različitoga broja elektrona u valentnoj ljuski. Atomi svih elemenata koji se nalaze u istoj periodi imaju isti broj ljusaka.
Kemijska svojstva elemenata iste SKUPINE su slična, ali ne i jednaka.
Elektroni valentne ljuske se s porastom protonskoga broja,
odnosno s povećanjem broja ljusaka, sve više udaljavaju od jezgre.
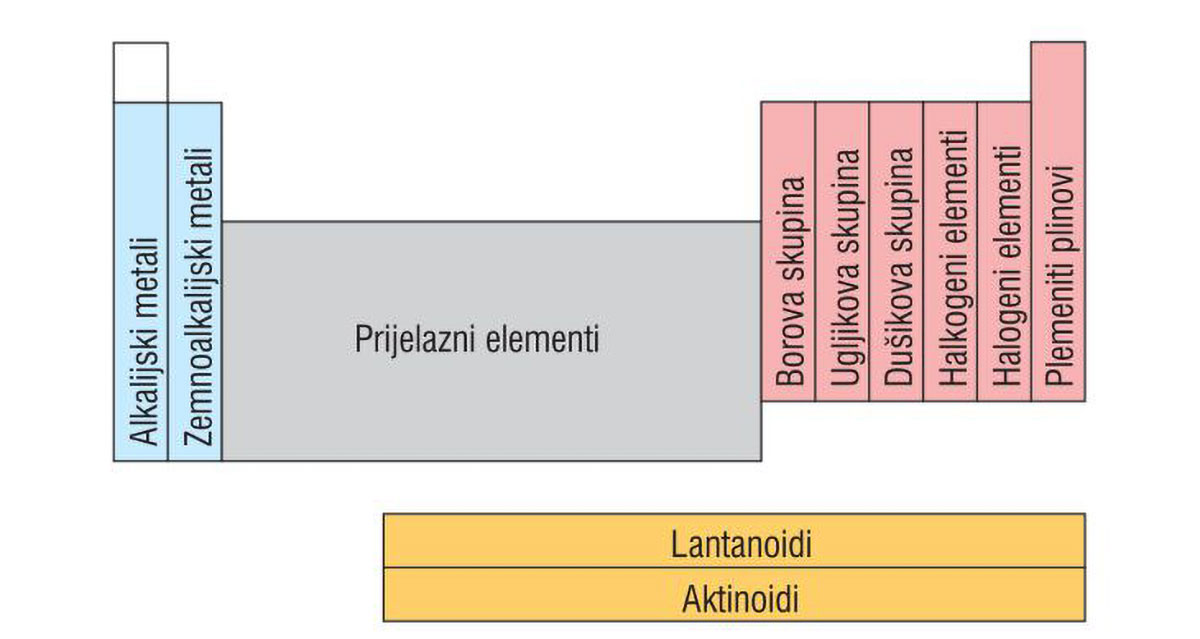
Osim označavanja brojevima, neke skupine imaju i posebne nazive.
- Alkalijski metali su elementi 1. skupine.
Ime su dobili po tome što s vodom daju jake lužine (alkalije). - Zemnoalkalijski metali su elementi 2. skupine.
Također čine jake lužine (alkalije).
Njihovi spojevi su česti sastojci Zemljine kore,
nazivaju se zemnoalkalijski elementi. - Elementi 13., 14. i 15. skupine
dobili su ime po prvom elementu u skupini.
Nazivamo ih borova, ugljikova i dušikova skupina elemenata. - Halkogeni elementi su elementi 16. skupine.
Naziv upućuje na to da ulaze u sastav ruda. - Halogeni elementi su elementi 17. skupine.
Naziv halogen upućuje na to da s metalima tvore soli. - Plemeniti plinovi su elementi 18. skupine.
Pri standardnim uvjetima, svi su u plinovitom stanju.
Ime su dobili prema svojstvu da, u pravilu, ne reagiraju s drugim elementima.
Kemijska svojstva elemenata iste SKUPINE su slična, a ne jednaka, jer se elektroni valentne ljuske s porastom protonskoga broja, odnosno s povećanjem broja ljusaka, sve više udaljavaju od jezgre. Osim označavanja brojevima, neke skupine imaju i posebne nazive.
- Alkalijski metali su elementi 1. skupine. Ime su dobili po tome što s vodom daju jake lužine (alkalije).
- Zemnoalkalijski metali su elementi 2. skupine. Također čine jake lužine (alkalije), a budući da su njihovi spojevi česti sastojci Zemljine kore, nazivaju se zemnoalkalijski elementi.
- Elementi 13., 14. i 15. skupine dobili su ime po prvom elementu u skupini i nazivamo ih borova, ugljikova i dušikova skupina elemenata.
- Halkogeni elementi su elementi 16. skupine. Naziv upućuje na to da ulaze u sastav ruda.
- Halogeni elementi su elementi 17. skupine. Naziv halogen upućuje na to da s metalima tvore soli.
- Plemeniti plinovi su elementi 18. skupine. Pri standardnim uvjetima, svi su u plinovitom stanju. Ime su dobili prema svojstvu da, u pravilu, ne reagiraju s drugim elementima.
Elektronska konfiguracija na temelju položaja elementa u periodnom sustavu
Elementi u periodnom sustavu dijele se u blokove prema vrsti orbitale koja se posljednja popunjava elektronima, pa prema tome razlikujemo elemente:
s-bloka
p-bloka
d-bloka
f-bloka.
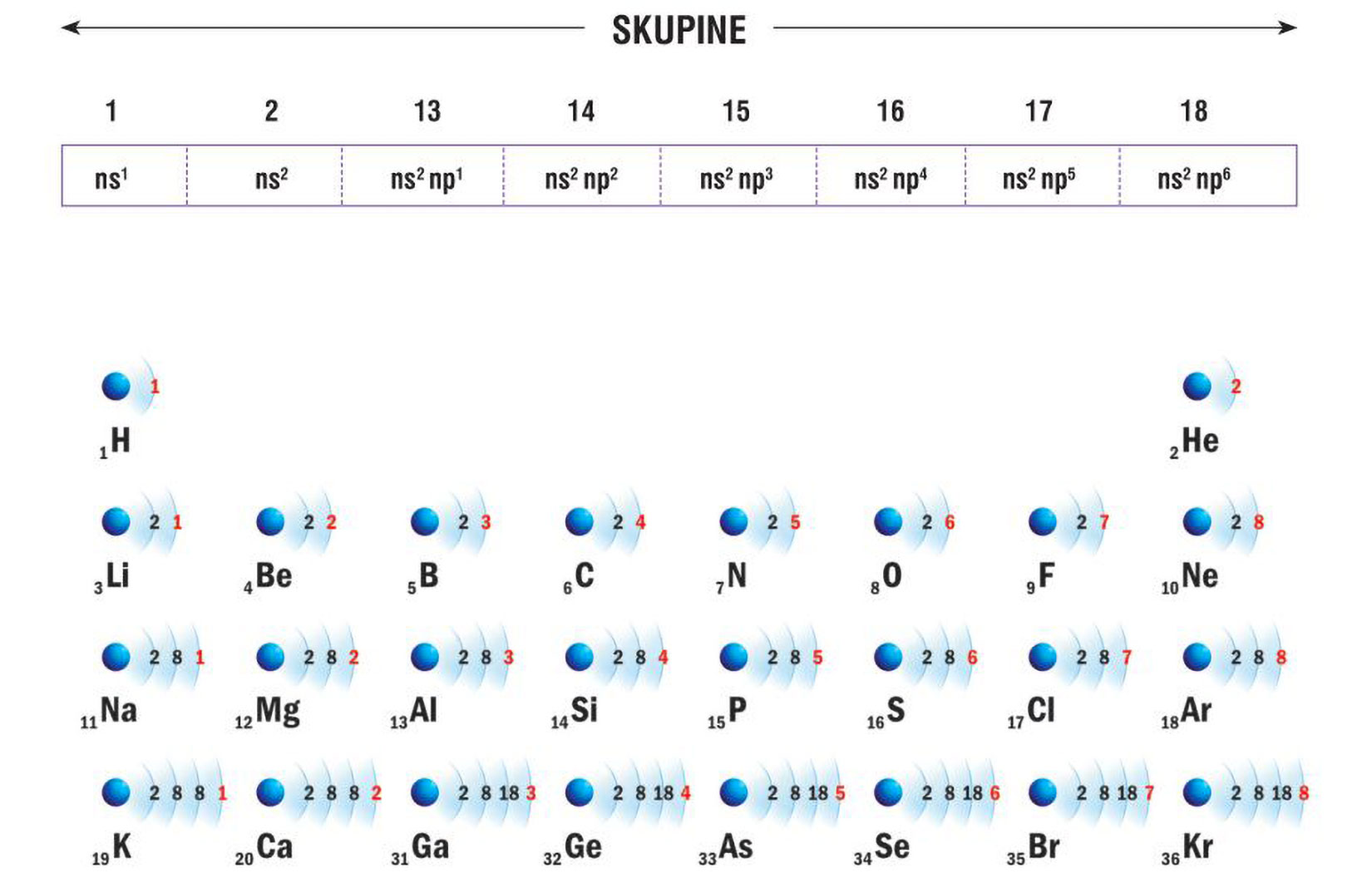
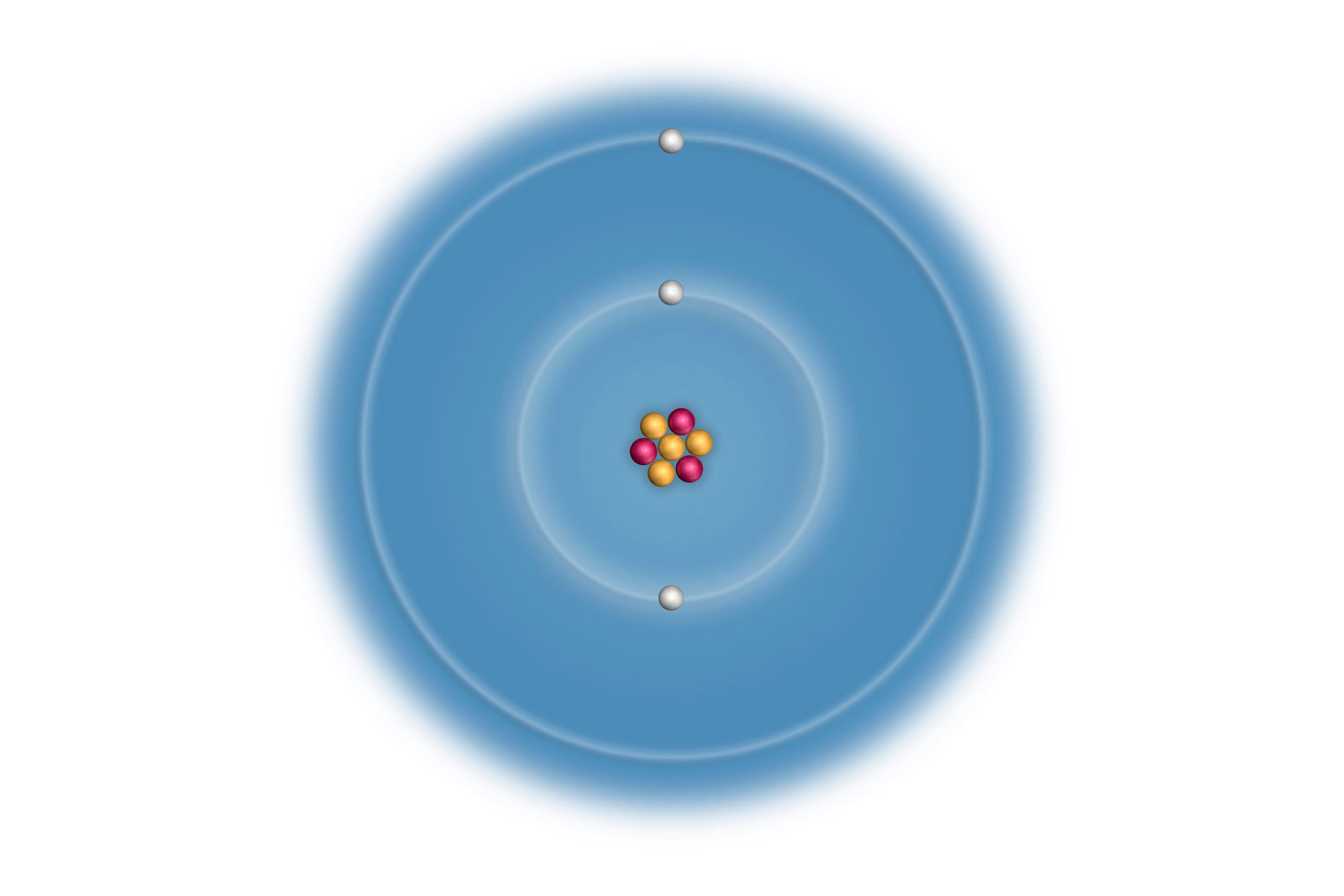
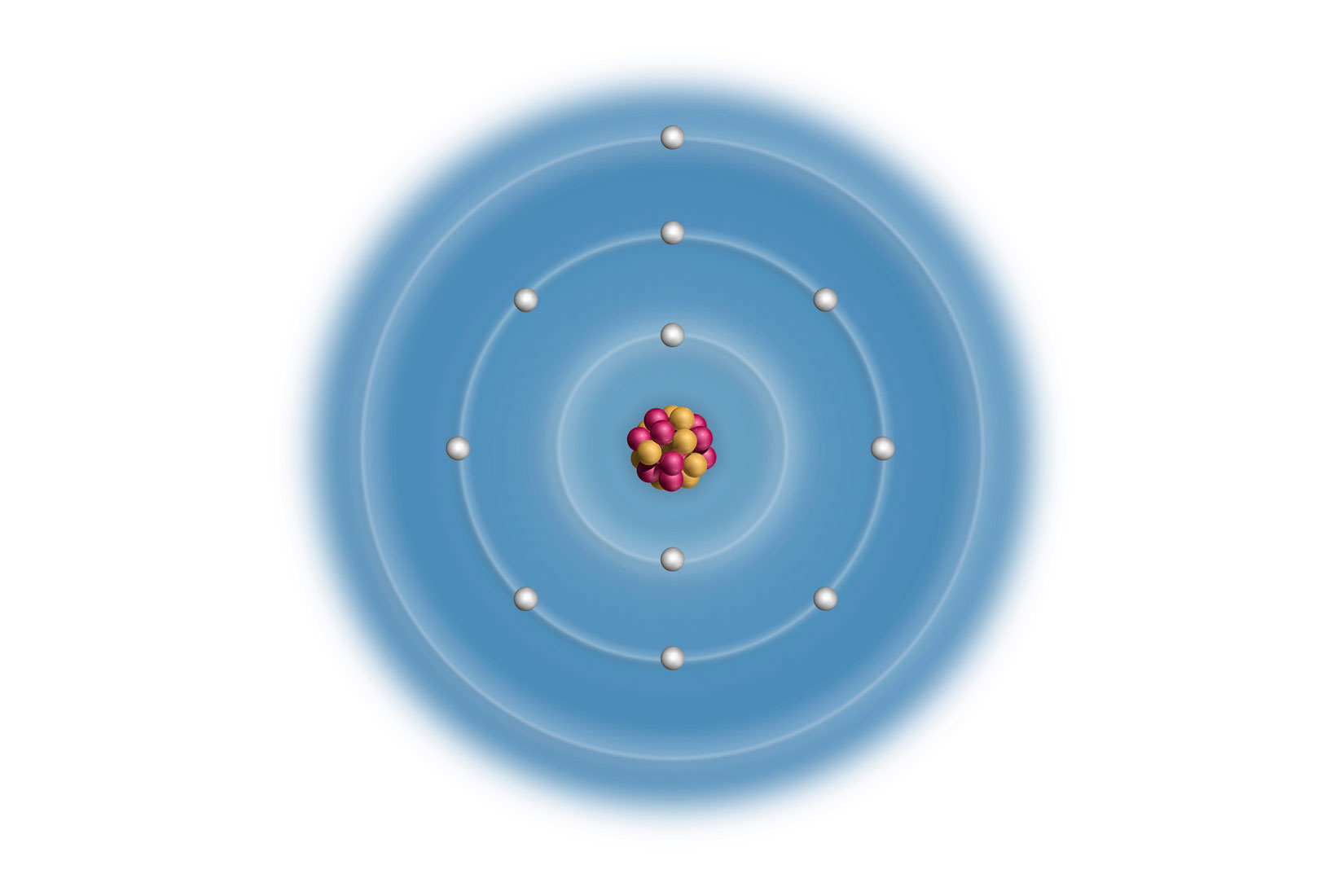
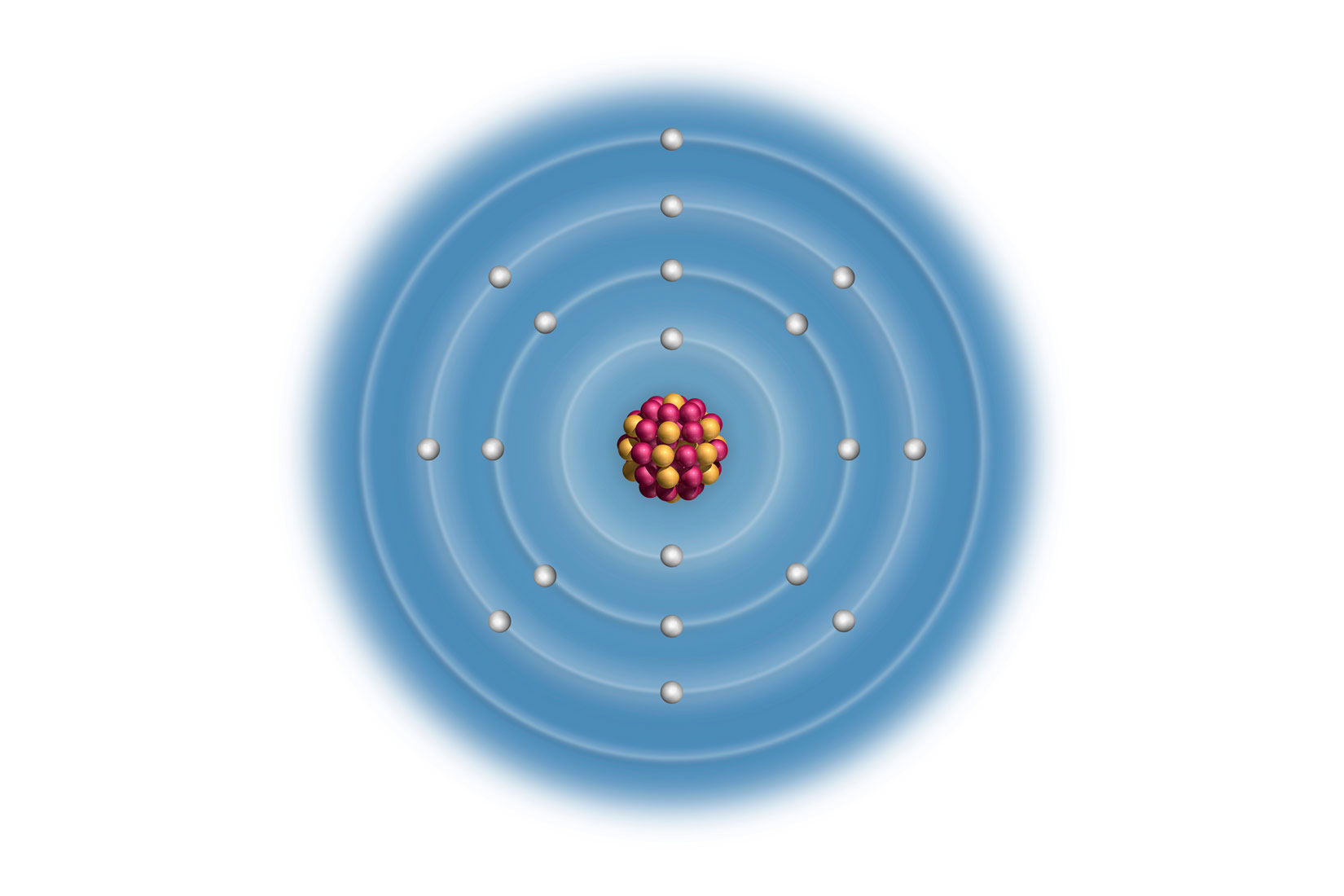
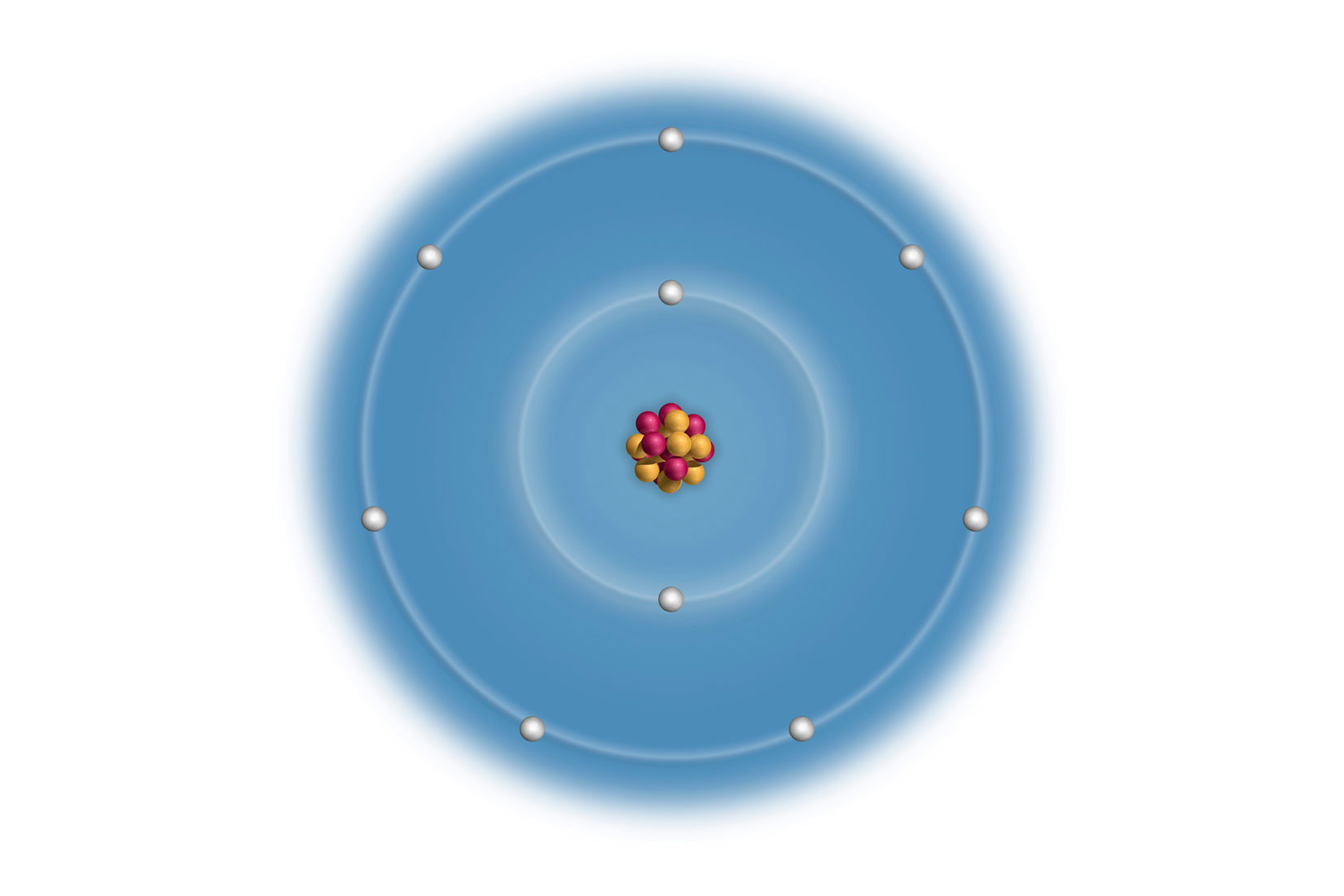
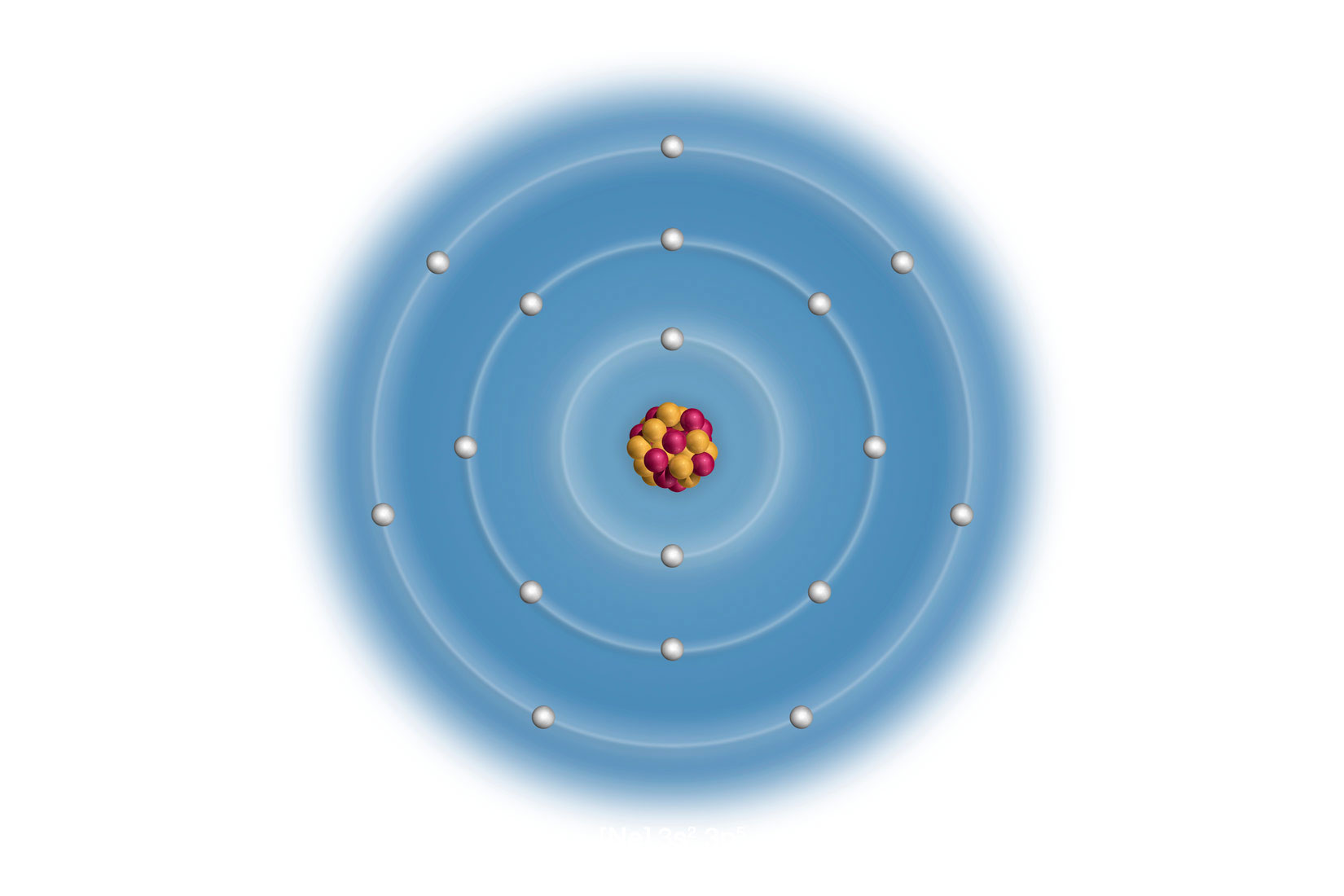
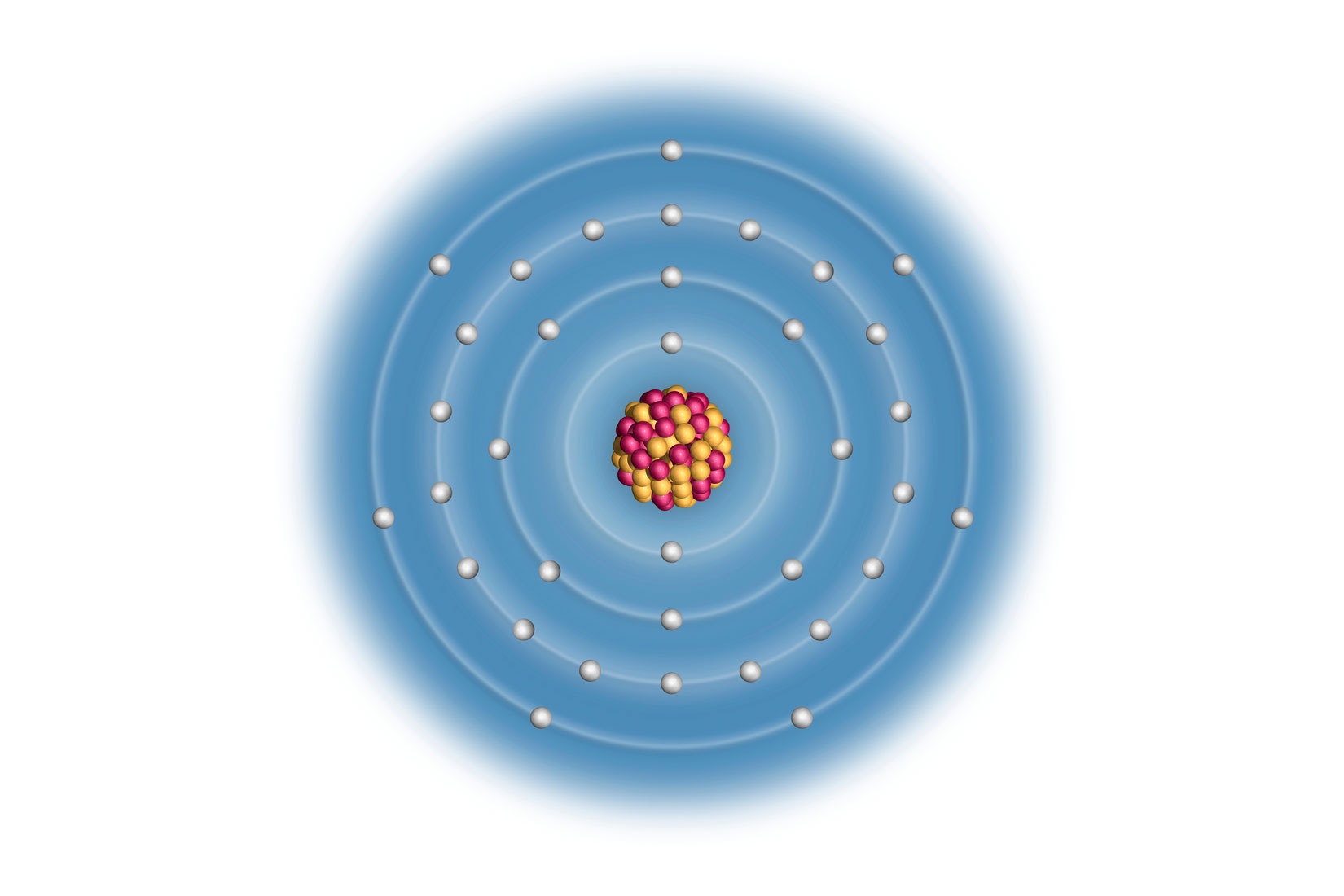
Elektronske konfiguracije atoma prva tri alkalijska metala:
Vanjski (valentni) elektroni atoma određuju
kemijska i fizikalna svojstva elementa.
Litij (Li), natrij (Na) i kalij (K) imaju u zadnjoj,
vanjskoj ljuski po jedan elektron.
Za prikazane atome, broj elektrona u vanjskoj ljusci odgovara
broju skupine u periodnom sustavu elemenata.
Svi elementi 1 skupine elemenata imaju 1 valentni elektron.
Elektronsku konfiguraciju valentnih ljusaka
za elemente 1. skupine možemo pisati ns1 (n – redni broj ljuske).
Elektronska konfiguracija valentne ljuske kalija (K) će biti 4s1 jer je u četvrtoj periodi. Elektronska konfiguracija valentne ljuske rubidija (Rb) 5s1 jer je u petoj periodi.
Elektronske konfiguracije prva tri halogena elementa
Vanjski (valentni) elektroni atoma određuju kemijska i fizikalna svojstva elementa. Uočavamo da atomi litija (), natrija () i kalija () imaju u zadnjoj, vanjskoj ljuski po jedan elektron. Za prikazane atome, broj elektrona u vanjskoj ljusci odgovara broju skupine u periodnom sustavu elemenata.
Atomi elemenata 1. skupine imaju 1 valentni elektron.
Elektronska konfiguracija valentnih ljusaka za atome elemenata 1. skupine je ( – redni broj ljuske), pa je elektronska konfiguracija valentne ljuske atoma kalija , a atoma rubidija jer je rubidij u petoj periodi.
Elektronske konfiguracije atoma prva tri halogena elementa:
Za atome elemenata 17. skupine općenita elektronska konfiguracija valentne ljuske je , pa je elektronska konfiguracija valentne ljuske atoma joda jer se jod nalazi u petoj periodi ().
Atomi elemenata iste glavne skupine imaju jednaku elektronsku konfiguraciju valentne ljuske.
S obzirom da su svojstva elemenata istih skupina slična, a elektronske konfiguracije njihovih valentnih ljusaka jednake, zaključujemo da upravo konfiguracije valentnih ljusaka određuju svojstva tih elemenata.
Na kraju…
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?