Elektronski omotač atoma
- shematski prikazati elektronske konfiguracije atoma različitih elemenata
- objasniti zašto atomi nekih elemenata d-bloka nemaju očekivanu elektronsku konfiguraciju, npr. bakar, krom, molibden, srebro
Uvod
Sunce obasjava Zemlju bijelom svjetlošću.
Bijela svijetlost je kombinacija svih duginih boja.
Svaka boja svjetla ima svoju valnu duljinu.
Svijetlost crvene i narančaste boje ima najdulje valne duljine.
Ta svjetlost prolazi gotovo neometano kroz atmosferu.
Svijetlost plave boje ima kratku valnu duljinu.
Ta svjetlost se raspršuje se po atmosferi u svim pravcima.
Zbog toga je danju nebo plave boje.
Kad Sunce obasja kapljicu vode ona se ponaša kao prizma.
Svjetlost se pri tom lomi i razlaže u boje spektra:
crvenu, narančastu, žutu, zelenu, plavu i ljubičastu.
Taj niz boja naziva se kontinuirani spektar.
Uvod
Sunce obasjava Zemlju bijelom svjetlošću, koja je kombinacija svih duginih boja. Svaka boja svjetla ima svoju valnu duljinu. Svjetlost crvene i narančaste boje ima najdulje valne duljine i prolazi gotovo neometano kroz atmosferu. Svjetlost plave boje ima kratku valnu duljinu i raspršuje se po atmosferi u svim pravcima. Zbog toga je danju nebo plave boje. Kad Sunce obasja kapljicu vode ona se ponaša kao prizma. Svjetlost se pri tom lomi i razlaže u boje spektra: crvenu, narančastu, žutu, zelenu, plavu i ljubičastu. Taj niz boja naziva se kontinuirani spektar.
Spektri i građa elektronskog omotača
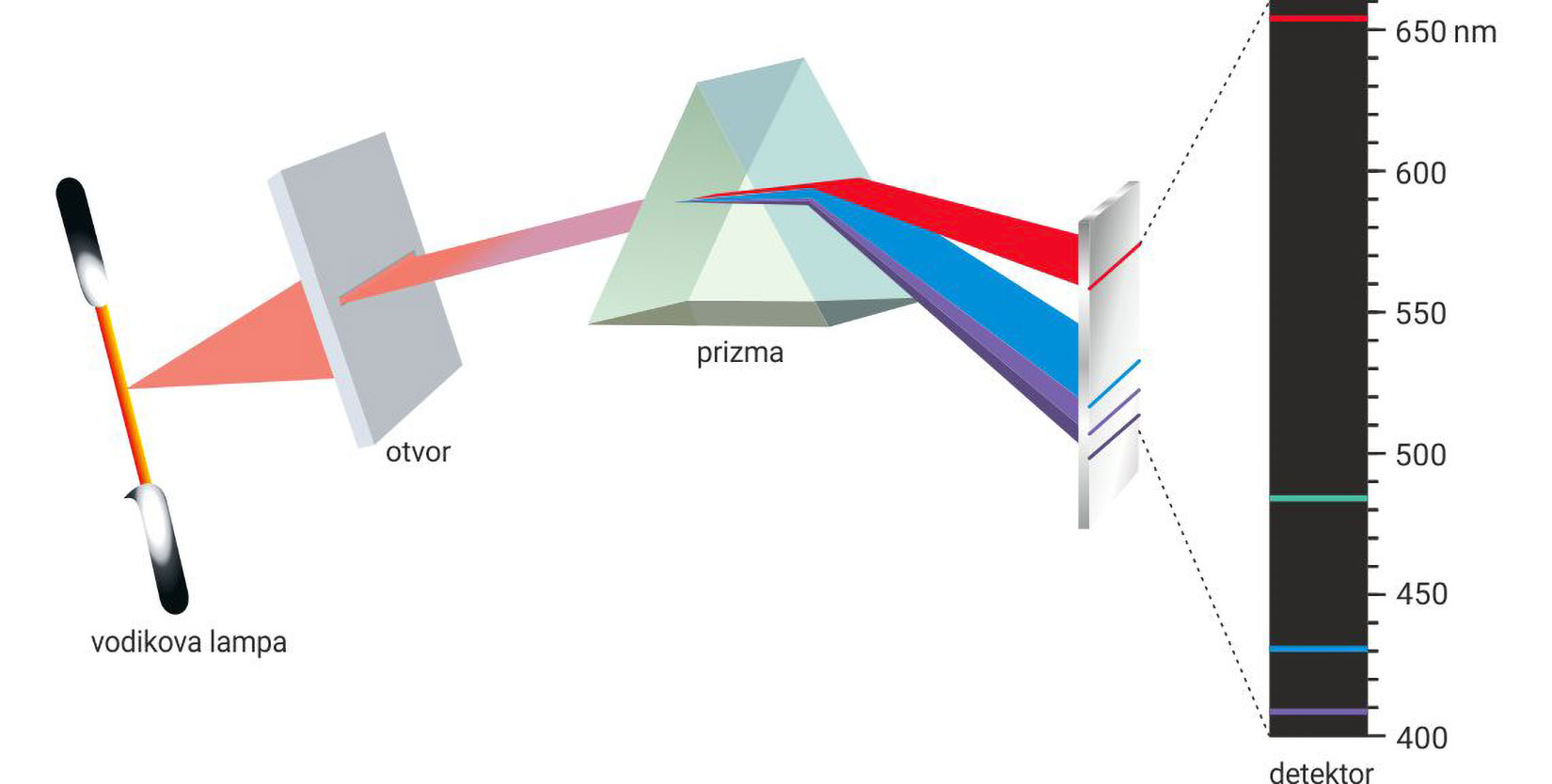
U drugoj polovici 19. stoljeća njemački fizičar Gustav Robert Kirchoff i kemičar Robert Wilhelm Bunsen zaključili su da pare metala ili zagrijani plinovi pod visokim naponom emitiraju različito obojenu svjetlost karakteristične valne duljine.
Alkalijski metali boje plamen jarkim bojama
Ako tako dobiveno obojeno svjetlo propustimo kroz staklenu prizmu, prijelaz jedne boje u drugu boju više nije kontinuiran, već nastaju odvojene linije. Taj se spektar naziva linijski spektar i specifičan je za svaku tvar.
Kvantna teorija i Bohrov model atoma
Svjetlost predstavlja jedan oblik energije koju odašilju atomi.
Godine 1900. Max Planck je postavio
teoriju o diskontinuiranosti energije.
To znači da užareno tijelo može emitirati ili apsorbirati
točno određenu energiju ili višekratnike te energije.
Najmanji iznos energije nazivamo kvant energije ili kvant (foton)
zračenja i računamo ga prema izrazu:
E = energija zračenja
h = Planckova konstanta;
ν = frekvencija zračenja
c = brzina svjetlosti;
λ = valna duljina
Kvantna teorija i Bohrov model atoma
Svjetlost predstavlja jedan oblik energije koju odašilju atomi. Godine 1900. Max Planck je postavio teoriju o diskontinuiranosti energije. To znači da užareno tijelo može emitirati ili apsorbirati točno određenu energiju ili višekratnike te energije. Najmanji iznos energije nazivamo kvant energije ili kvant zračenja (foton) i računamo ga prema izrazu:
E = energija zračenja
h = Planckova konstanta;
ν = frekvencija zračenja
c = brzina svjetlosti;
λ = valna duljina
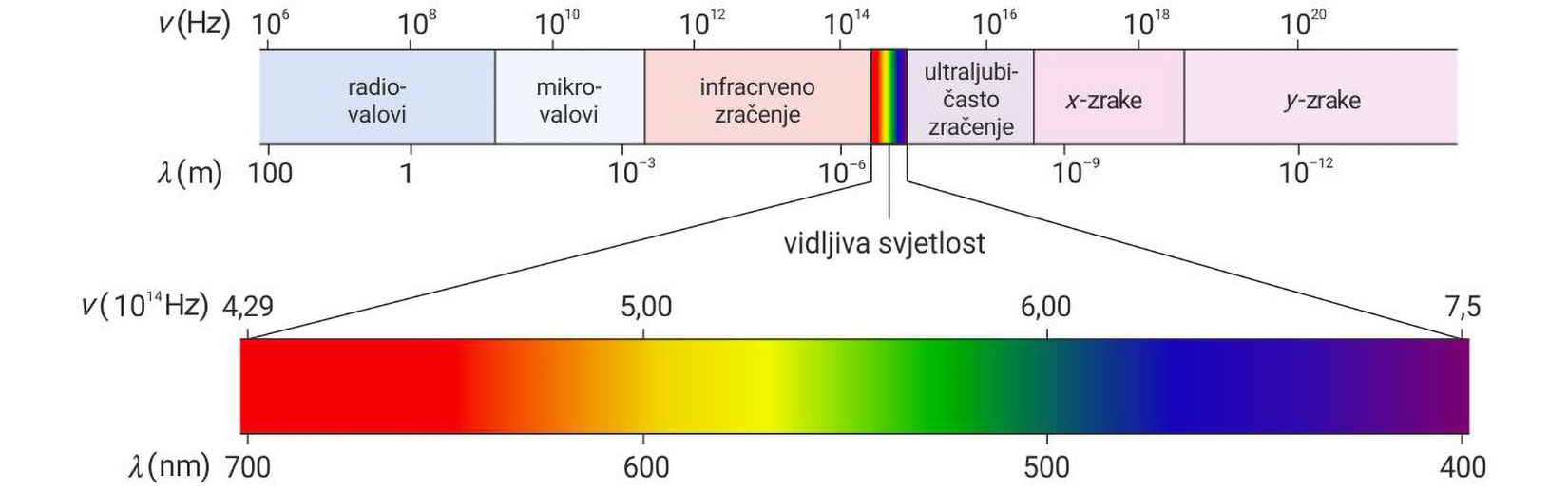
Slika prikazuje dio kontinuiranog spektra elektromagnetskog zračenja. Budući da takav spektar daju sve užarene čvrste tvari, on nije specifičan za pojedinu tvar.
Na temelju slike kontinuiranoga spektra elektromagnetskoga zračenja, odgovorite na sljedeća pitanja.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koja se od navedenih frekvencija nalazi u vidljivom dijelu spektra?
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Odaberite točne tvrdnje:
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Godine 1913. danski je fizičar Niels Bohr, na osnovi Planckove teorije,
postavio teoriju o građi atoma.
Prema toj teoriji raspored elektrona u atomu nije slučajan.
Prema Bohru, elektroni se mogu nalaziti oko jezgre
samo na točno određenim kvantiziranim putanjama.
Svakoj se od putanja pripisuje određena količina energije.
Energija elektrona koji se kreće putanjom točno je određena.
Kažemo da je energija elektrona kvantizirana.
Energetski najstabilnije stanje atoma naziva se stacionarno stanje.
U stacionarnom stanju atom ne apsorbira i ne emitira energiju.
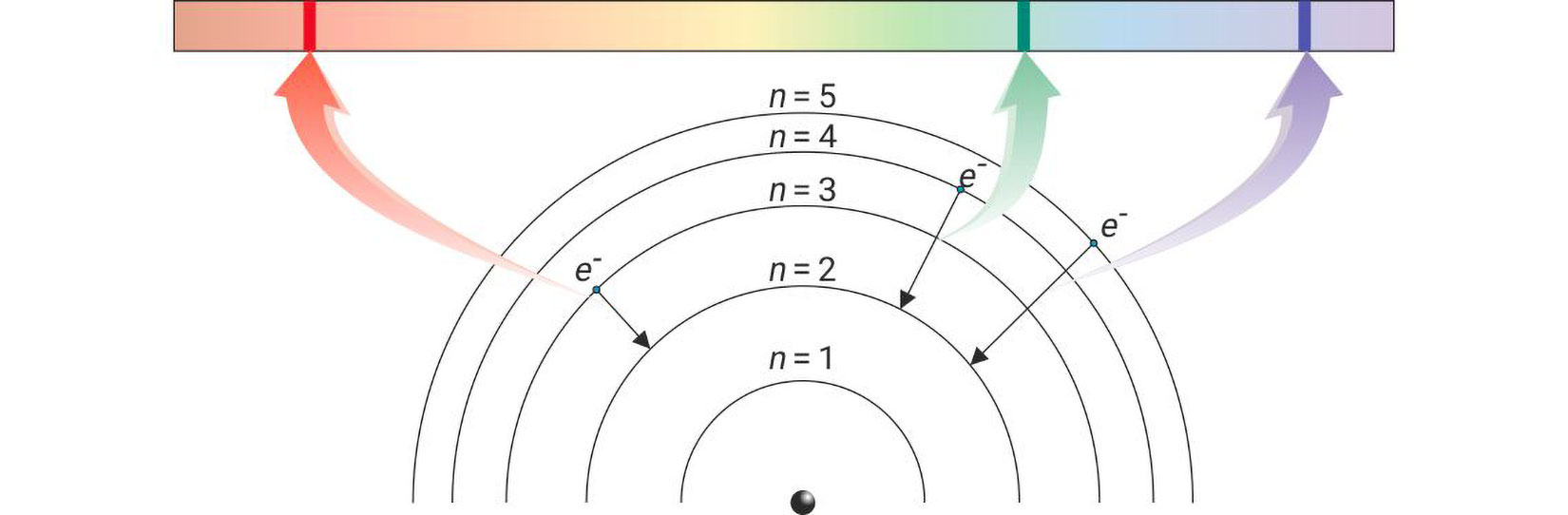
Godine 1913. danski je fizičar Niels Bohr, na osnovi Planckove teorije, postavio teoriju o građi atoma prema kojoj raspored elektrona u atomu nije slučajan. Prema Bohru, elektroni se mogu nalaziti oko jezgre samo na točno određenim kvantiziranim putanjama. Budući da se svakoj od putanja pripisuje određena količina energije, energija elektrona koji se kreće putanjom točno je određena. Kažemo da je energija elektrona kvantizirana. Energetski najstabilnije stanje atoma naziva se stacionarno stanje. U stacionarnom stanju atom ne apsorbira i ne emitira energiju.
Ako zagrijavanjem atomu dovedemo energiju, atom će prijeći u pobuđeno stanje. Kada atom apsorbira energiju elektron(i) prelazi u viši energijski nivo. Pri povratku elektrona iz višeg u niži nivo, atom emitira energiju u obliku svjetlosti (kvant zračenja). O razlici energija početnog i konačnog stanja elektrona, ovisi hoće li valna duljina zračenja biti u vidljivom dijelu spektra.
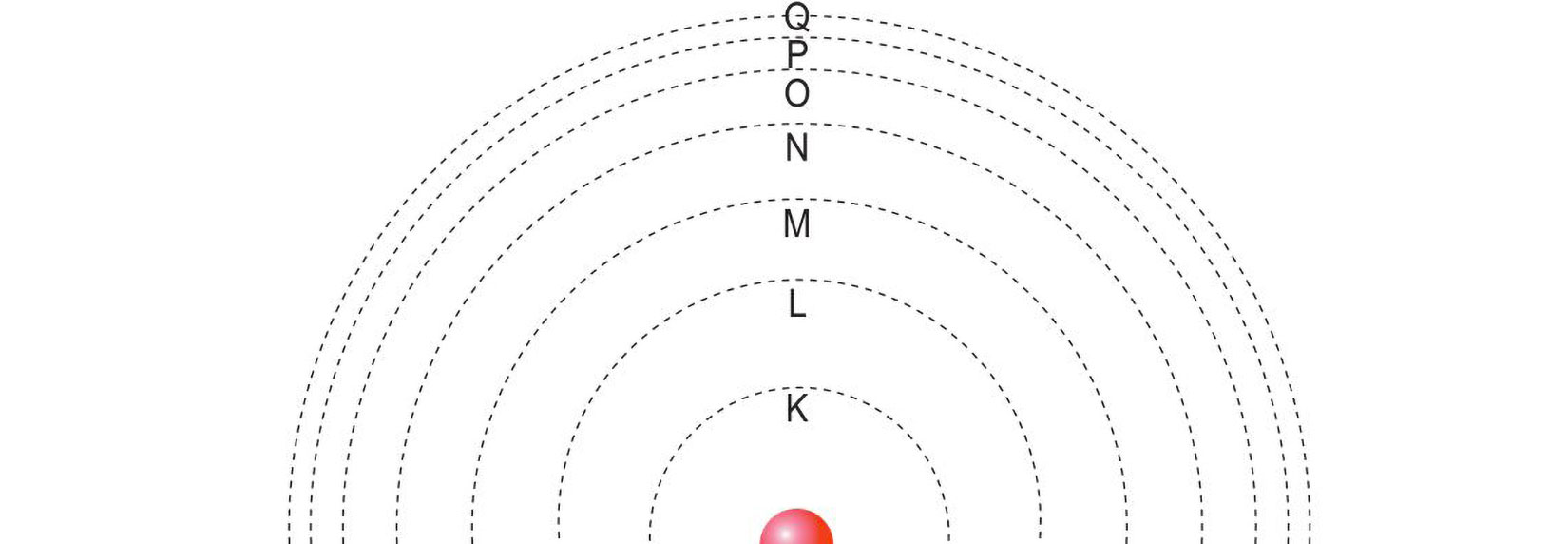
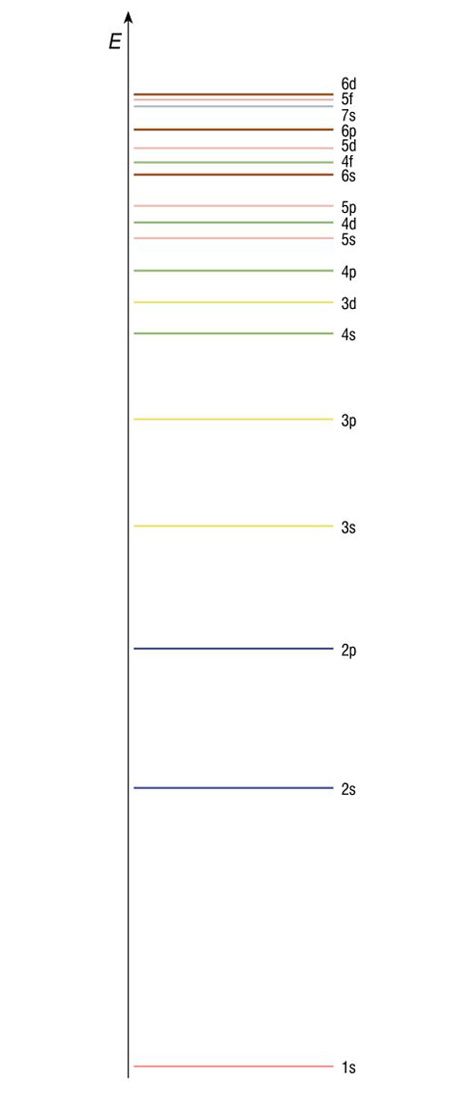
Elektronski omotač atoma
Elektroni se nalaze u elektronskom omotaču. Energetske razine ili ljuske u kojima se mogu nalaziti elektroni označavamo brojkama od 1 do 7 ili slovima K, L, M, N, O, P, Q .
Unutar ljuske elektroni se raspoređuju u podljuske.
Unutar podljuske elektroni se nalaze u orbitalama.
Prema Bohrovm modelu, elektroni se kreću po orbitama.
Prema kvantno-mehaničkom opisu atoma,
elektroni se nalaze u orbitalama.
Atomska orbitala je matematička funkcija koja opisuje svojstva elektrona u atomu.
Uz pomoć nje izračunavaju se fizikalne veličine stanja kao
energija elektrona ili udaljenost elektrona od jezgre.
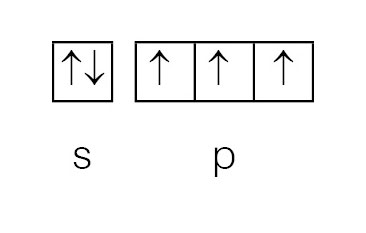
Podljuske označavamo slovima s, p, d i f.
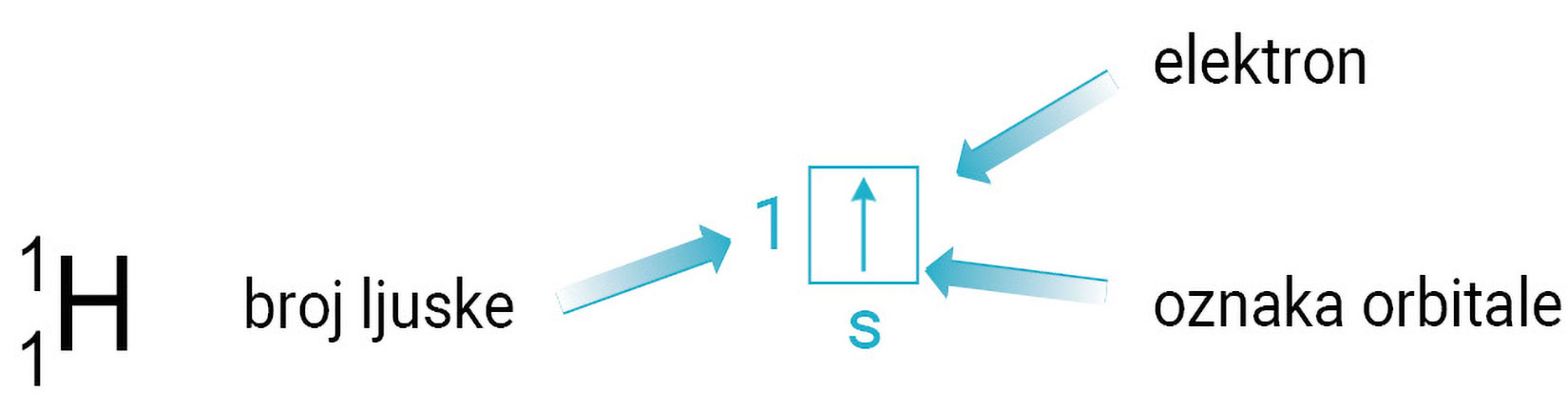
Shematski orbitale prikazujemo kvadratićem.
Unutar ljuske elektroni se raspoređuju u podljuske. Unutar podljuske elektroni se nalaze u orbitalama. Naime, za razliku od Bohrova modela prema kojemu se elektroni kreću po orbitama, prema kvantno-mehaničkom opisu atoma, elektroni se nalaze u orbitalama. Atomska orbitala je matematička funkcija koja opisuje svojstva elektrona u atomu. Uz pomoć nje izračunavaju se fizikalne veličine stanja kao, na primjer, energija elektrona ili udaljenost elektrona od jezgre. Podljuske označavamo slovima s, p, d i f. Shematski orbitale prikazujemo kvadratićem.
| Ljuska | Orbitala | Najveći broj elektrona | Najveći broj elektrona |
|---|---|---|---|
| n=1(K) |  |
2 |
2 |
| n=2(L) | 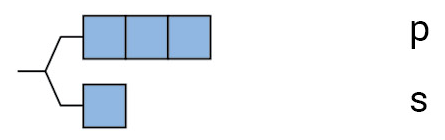 |
6 2 |
8 |
| n=3(M) | 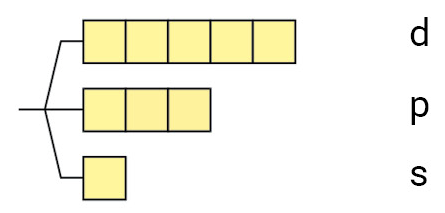 |
10 6 2 |
18 |
| n=4(n) | 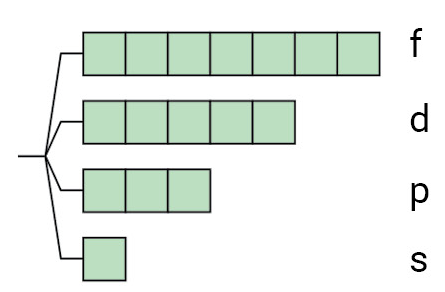 |
14 10 6 2
|
32 |
Najveći broj elektrona u ljuski: . U svakoj se orbitali mogu nalaziti po dva elektrona suprotnog spina (Paulijev princip isključenja).
Spin elektrona može se zamisliti vrtnjom elektrona oko vlastite osi. Elektrone prikazujemo strelicama. Smjer strelice pokazuje spin elektrona, ↑↓ .
Elektronska konfiguracija atoma
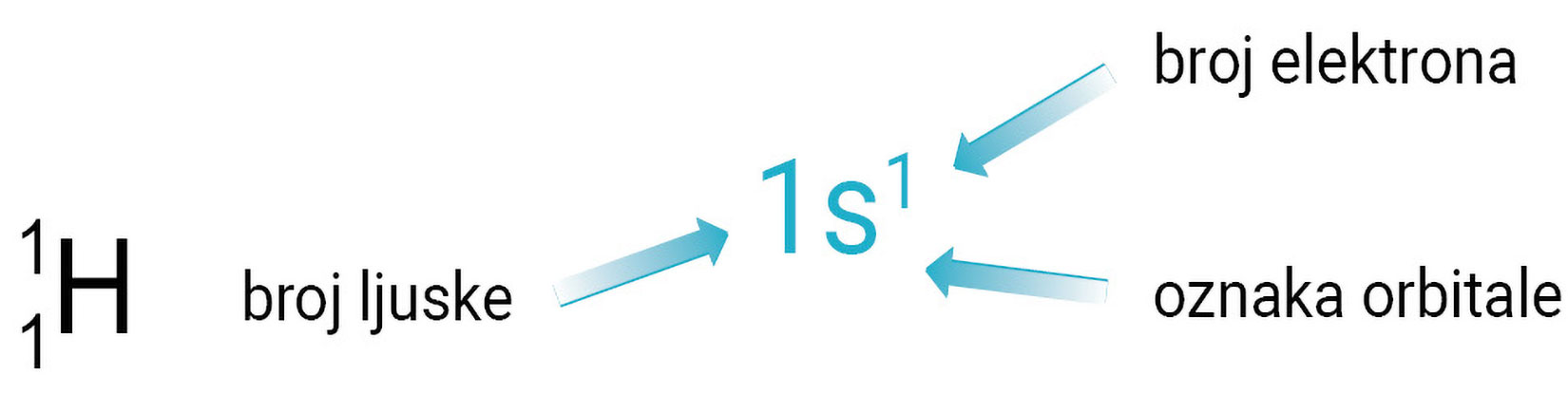
Raspored elektrona po ljuskama naziva se
a shematski prikazujemo ovako:
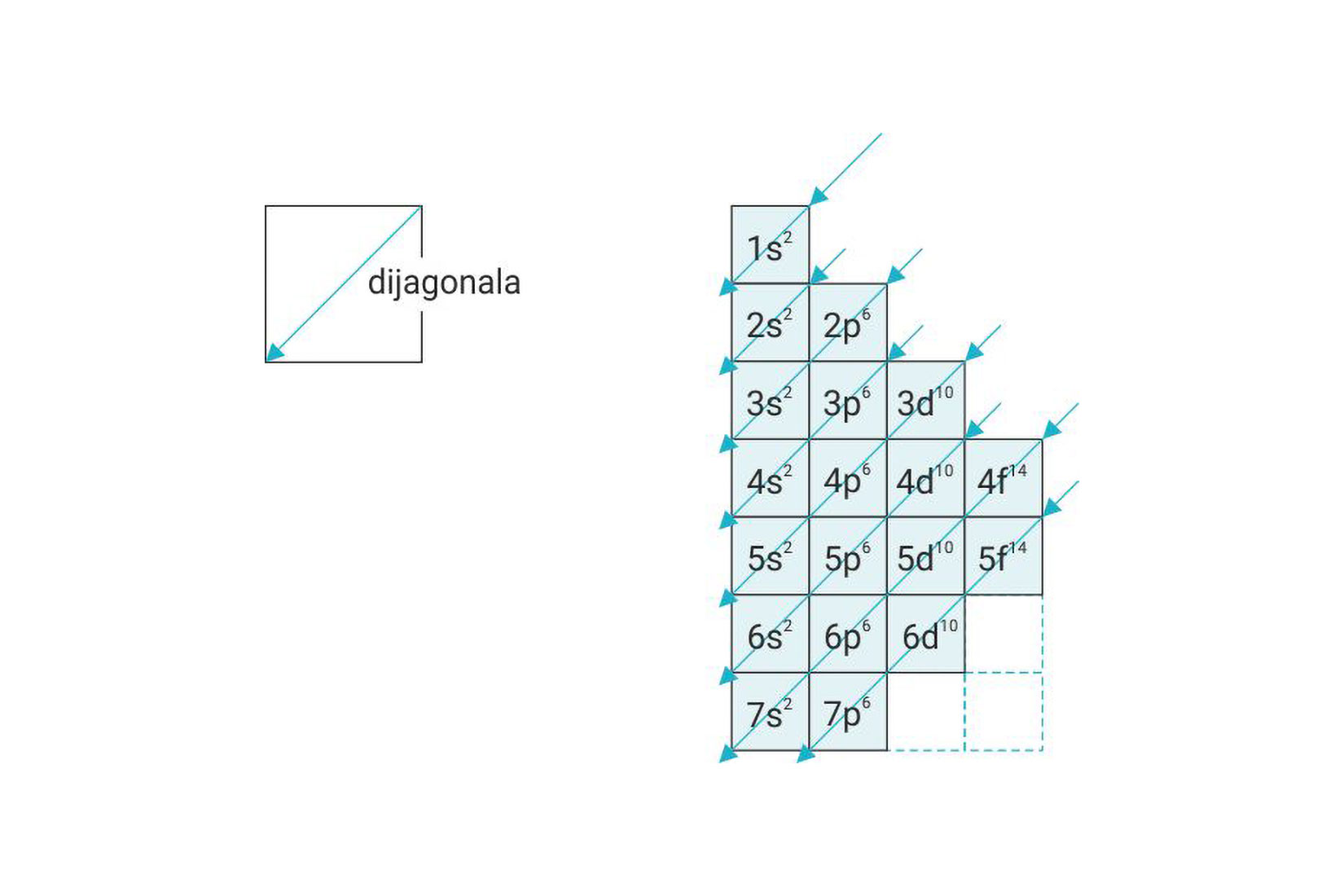
Broj elektrona u određenoj vrsti orbitale označava se kao desni gornji indeks na oznaci orbitale. Na primjer znači da je u s-orbitali prve ljuske jedan elektron, a čita se jedan-es-jedan. Orbitale se popunjavaju elektronima redom od orbitala niže prema orbitalama više energije.
Redoslijed popunjavanja orbitala elektronima naziva se pravilo dijagonala.
Istovrsne orbitale popunjavaju se uvijek tako da najveći broj elektrona bude nesparen, jer je tada energija atoma najmanja, a atom najstabilniji, prema Hundovom pravilu.
Riješeni primjer 1
Kako napisati elektronsku konfiguraciju atoma natrija i atoma željeza?
Elektronska konfiguracija atoma natrija; 11Na
Atom natrija ima protonski broj 11, prema tome i 11 elektrona.
Budući da se natrij nalazi u trećoj periodi, atom natrija ima tri ljuske: K, L i M.
Prema pravilu dijagonale popunjavaju se redom -orbitale.
Elektronska konfiguracija atoma natrija prema tome je:
ili .
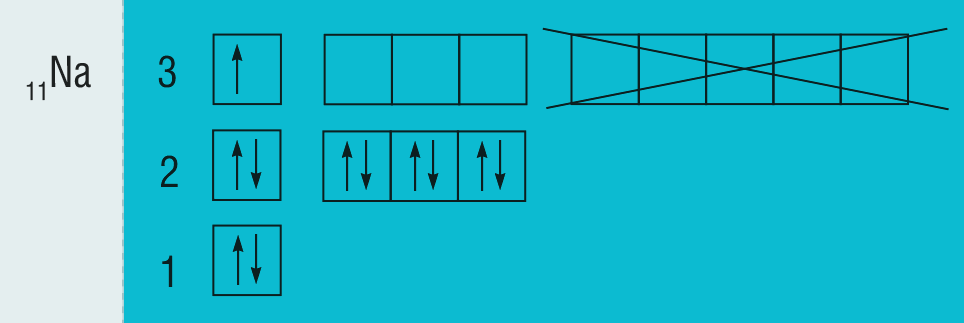
Budući da u vanjskoj ljuski atoma natrija može biti najviše osam elektrona, d-orbitale zadnje ljuske ne treba crtati.
Elektronska konfiguracija atoma željeza; 26Fe
Atom željeza ima protonski broj 26, prema tome i 26 elektrona.
Budući da se željezo nalazi u četvrtoj periodi, atom željeza ima četiri ljuske: K, L, M i N.
Prema pravilu dijagonale popunjavaju se redom -orbitale.
Elektronska konfiguracija atoma željeza prema tome je:
ili .

Nakon popunjavanja 4s-orbitale počinju se popunjavati 3d-orbitale (Pravilo dijagonale) i to redom od 21. skandija () do 30. cinka (), tako da broj nesparenih elektrona bude najveći (Hundovo pravilo).
Zadatak
Prikažite shematski i napišite elektronsku konfiguraciju za atom: a) kalija i b) cinka.
Točnost svojih prikaza provjerite na poveznici „Elektronske konfiguracije elemenata”. Generalić, Eni. Periodni sustav elemenata [online] EniG. Split: Kemijsko-tehnološki fakultet. Dostupno na: [25.8.2017.]
Valentni elektroni
Vanjsku ljusku nazivamo i
u valentnoj ljuski
| Tablica 1. Elektronske konfiguracije atoma fosfora, klora i kalija (elektronska konfiguracija valentne ljuske istaknuta je bojom) | |
| 15P | 1s22s22p63s23p3 |
| 17Cl | 1s22s22p63s23p5 |
| 19K | 1s22s22p63s23p64s1 |
Atomi koje skupine elemenata u periodnom sustavu uvijek imaju popunjenu valentnu ljusku?
Plemeniti plinovi imaju vanjsku ljusku s osam (osim helija s dva) elektrona. Iz toga proizlaze njihova kemijska svojstva. Plemeniti plinovi uglavnom su inertni, tj. rijetko reagiraju s drugim elementima i u pravilu pri uobičajenim uvjetima ne tvore kemijske spojeve.
Iznimke u elektronskoj konfiguraciji
Neki elementi, s obzirom na njihov položaj
u periodnom sustavu elemenata,
nemaju očekivanu elektronsku konfiguraciju.
Primjerice, elektronske konfiguracije kroma, bakra, molibdena, srebra i zlata su:
Elektronska konfiguracija atoma kroma očekivano bi bila .
Budući da je energetski povoljnija konfiguracija sa maksimalnim brojem nesparenih d-elektrona,
elektronska konfiguracija atoma kroma je: .
Iznimke u elektronskoj konfiguraciji
Neki elementi, s obzirom na njihov položaj u periodnom sustavu elemenata, nemaju očekivanu elektronsku konfiguraciju. Primjerice, elektronske konfiguracije kroma, bakra, molibdena, srebra i zlata su:
Elektronska konfiguracija atoma kroma očekivano bi bila , ali budući da je energetski povoljnija konfiguracija sa maksimalnim brojem nesparenih d-elektrona, elektronska konfiguracija atoma kroma je: .
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Pet valentnih elektrona ima atom:
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?