Entalpija
- identificirati pojam entalpije i unutarnje energije
- utvrditi promjenu entalpije i entalpiju neke kemijske reakcije
- napisati termokemijsku jednadžbu
- izračunati reakcijsku entalpiju
- skicirati entalpijski dijagram.
Uvod
Još se u 19. stoljeću mislilo da je toplina tvar.
Tu tvrdnju opovrgnuo je njemački fizičar Rudolf Julius Emanuel Clausius (čitajte: Klauzius).
On je prvi opisao toplinu kao kinetičku energiju čestica tvari.
Uvod
Još se u 19. stoljeću mislilo da je toplina tvar. Tu tvrdnju opovrgnuo je njemački fizičar Rudolf Julius Emanuel Clausius (čitajte; Klauzius), koji je prvi opisao toplinu kao kinetičku energiju čestica tvari.
Termodinamika je grana fizike koja proučava izmjenu energije kao što su toplina (Q) i rad (W).
Termokemija je grana kemije koja proučava izmjenu topline do koje dolazi u kemijskim reakcijama.
Jedinke koje izgrađuju tvari (atomi, molekule, ioni)
imaju pri nekoj temperaturi određenu kinetičku (Ek) i potencijalnu energiju (Ep).
Zbroj kinetičke (Ek) i potencijalne energije (Ep)
jedinki u sustavu čini unutarnju energiju sustava, U.
U = Ek + Ep
Ukupna energija (U) proučavanog sustava i njegove okoline je stalna.
Ukupna energija, U, sustava i njegove okoline je stalna.
Promjenu unutarnje energije, ΔU, u sustavu, promjenu topline, Q i promjenu rada, W, povezuje Prvi zakon termodinamike.
Toplina (Q) i rad (W) se ne mijenjaju.
Rad (W) je obavljen, a toplina (Q) izmijenjena.
ΔU = ΔQ + ΔW
ΔU = U2 + U1
gdje je U2 konačno, a U1 početno stanje sustava. Ako se događa promjena (prirast) neke od veličina, to se označava simbolom Δ (čitaj: delta)
Toplina, Q i rad, W, dva su oblika energije koji mogu prelaziti s jednog sustava na drugi:
- ili sa sustava na okolinu,
- ili s okoline na sustav.
Ako je, primjerice, sustavu dovedena toplina, dogovoreno je da se to označava s Q>0.
Termodinamika je grana fizike koja proučava izmjenu energije kao što su toplina i rad. Termokemija je grana kemije koja proučava izmjenu topline do koje dolazi u kemijskim reakcijama. Jedinke koje izgrađuju tvari (atomi, molekule, ioni) imaju pri određenoj temperaturi određenu kinetičku i potencijalnu energiju. Zbroj kinetičke i potencijalne energije jedinki u sustavu čini unutarnju energiju sustava, U.
Ukupna energija, U, sustava i njegove okoline je stalna. Promjenu unutarnje energije, , u sustavu, promjenu topline, Q i promjenu rada, W, povezuje Prvi zakon termodinamike. Toplina i rad se ne mijenjaju. Rad je obavljen, a toplina izmijenjena.
gdje je konačno, a početno stanje sustava. Ako se događa promjena (prirast) neke od veličina, to se označava simbolom .
Toplina, Q i rad, W, dva su oblika energije koji mogu prelaziti s jednog sustava na drugi ili sa sustava na okolinu ili s okoline na sustav.
Ako je, primjerice, sustavu dovedena toplina, dogovoreno je da se to označava s .
Više informacija o prvom zakonu termodinamike možete pronaći u jedinici 2.5 Prvi zakon termodinamike u DOS-u Fizika 2.
Entalpija
U termodinamici je važna funkcija entalpija.
Entalpija se naziva funkcijom stanja jer ne ovisi o putu reakcije.
Entalpija ovisi samo o stanju, tlaku i temperaturi.
Veličina entalpije (Hi) u pojedinom stanju mjeri se pri stalnom tlaku (p) uz promjenu volumena (pVi):
Hi = Ui + pVi
Ako se pri stalnom tlaku u nekoj fizikalnoj ili kemijskoj reakciji oslobodi ili potroši neka količina topline (Qp), onda promjena topline odgovara promjeni entalpije (ΔH).
Q ∙ p = ΔH
ΔH = H2 – H1
Qp – oslobođena ili utrošena toplina pri konstantnom tlaku,
H2 – konačno stanje
H1 – početno stanje
Standardna reakcijska entalpija
Standardna reakcijska entalpija predstavlja količinu topline (Q) koja se oslobađa ili troši u nekoj kemijskoj reakciji pri tlaku (p) od 100 kPa.
Označava se ΔrH°.
Izraz „standardna“ odnosi se na činjenicu da je entalpija mjerena pri tlaku (p)
koji je dogovoren kao standardan, a to je tlak (p) od 100 kPa (jedinicu čitamo: kiloPaskala).
Da bismo standardnu entalpiju razlikovali od entalpije koja je mjerena pri nekom drugom tlaku (p), standardna entalpija dobiva oznaku kružića uz gornju desnu stranu slova H°.
Entalpija
U termodinamici je važna funkcija entalpija, H, koju se naziva funkcijom stanja jer ne ovisi o putu reakcije, već ovisi samo o stanju, tlaku i temperaturi. Veličina entalpije u pojedinom stanju mjeri se pri stalnom tlaku uz promjenu volumena:
Ako se pri stalnom tlaku u nekoj fizikalnoj ili kemijskoj reakciji oslobodi ili potroši neka količina topline Qp , onda promjena topline odgovara promjeni entalpije, .
Qp – oslobođena ili utrošena toplina pri konstantnom tlaku, p
– konačno stanje sustava
– početno stanje sustava
Standardna reakcijska entalpija
Standardna reakcijska entalpija predstavlja količinu topline koja se oslobađa ili troši u nekoj kemijskoj reakciji pri tlaku od 100 kPa i označava se . Mjerna jedinica za reakcijsku entalpiju je .
Izraz „standardna“ odnosi se na činjenicu da je entalpija mjerena pri tlaku koji je dogovoren kao standardan, a to je tlak od 100 kPa.
Da bismo standardnu entalpiju razlikovali od entalpije koja je mjerena pri nekom drugom tlaku, standardna entalpija dobiva oznaku kružića uz gornju desnu stranu slova .
Brojčana vrijednost reakcijske standardne entalpije ΔrH°odnosi se na množine tvari navedene u napisanim jednadžbama kemijskih reakcija.
Ako u reakciji dva mola vodika (H2) s jednim molom kisika (O2) nastanu dva mola vode (H2O), oslobođena toplina iznosi 571,6 kJ.
Reakcija je egzotermna, ΔH° < 0.
2H2(g) + O2(g) → 2H2O(l)
ΔrH° = 571,6 kJ mol–1
Jednadžbu kemijske reakcije u kojoj su navedena agregacijska stanja reaktanata i produkata kao i reakcijska entalpija nazivamo termokemijskom jednadžbom.
Za reakciju u suprotnom smjeru brojčana vrijednost reakcijske entalpije (ΔrH°) se ne mijenja.
Mijenja se samo predznak jer je reakcija endotermna, ΔH° > 0.
2H2O(l) → 2H2(g) + O2(g)
ΔrH° = 571,6 kJ mol–1
Ako koeficijente u jednadžbi podijelimo s 2 (:), dijelimo s 2 (:) i vrijednost reakcijske entalpije.
H2O(l) → H2(g) + 1/2 O2(g)
ΔrH° = 285,5 kJ mol–1
Na vrijednost standardne reakcijske entalpije osim broja jedinki reaktanata i produkata utječu i agregacijska stanja tvari u reakciji.
Primjerice, ako u reakciji dva mola vodika (H2) s jednim molom kisika (O2) nastanu dva mola vodene pare, oslobodi se toplina (ΔrH°) je 483,6 kJ.
2H2(g) + O2(g) → 2H2O(g)
ΔrH° = –483,6 kJ mol–1
Ako u reakciji dva mola vodika (H2) s jednim molom kisika (O2) nastanu dva mola vode (H2O), oslobodi se toplina od 571,6 kJ.
Količina topline koja se oslobodila u reakciji čiji je produkt vodena para manja < je za količinu topline koja se utrošila na isparavanje 2 mola vode (H2O) u vodenu paru.
Standardna entalpija stvaranja
Standardna entalpija stvaranja predstavlja količinu topline koja se oslobađa ili troši nastankom 1 mola spoja nastalog (stvorenog) od kemijskih elemenata u njihovim standardnim stanjima pri tlaku (p) od 100 kPa.
Standardna entalpija stvaranja za svaki kemijski element u njegovu standardnom stanju, prema dogovoru, ima vrijednost 0.
Označava se s ΔfH°.
Mjerna jedinica je kJ mol–1 (čitamo: kilodžul po molu).
Oznaka f znači engl. formation = stvaranje.
Standardno stanje tvari je najstabilniji oblik čiste tvari pri tlaku (p) od 100 kPa.
Primjerice, grafit i dijamant su alotropske modifikacije ugljika (C).
Grafit kao stabilnija modifikacija ima standardnu entalpiju 0 kJ mol–1.
Dijamant ima standardnu entalpiju 1,895 kJ mol–1.
Brojčana vrijednost reakcijske standardne entalpije, , odnosi se na množine tvari navedene u napisanim jednadžbama kemijskih reakcija.
Ako u reakciji dva mola vodika s jednim molom kisika nastanu dva mola vode, oslobođena toplina iznosi 571,6 kJ, dakle reakcija je egzotermna, .
Jednadžbu kemijske reakcije u kojoj su navedena agregacijska stanja reaktanata i produkata kao i reakcijska entalpija nazivamo termokemijskom jednadžbom.
Za reakciju u suprotnom smjeru brojčana vrijednost reakcijske entalpije se ne mijenja, ali se mijenja predznak jer je reakcija endotermna, .
Ako koeficijente u jednadžbi podijelimo s 2, dijelimo s 2 i vrijednost reakcijske entalpije.
Na vrijednost standardne reakcijske entalpije osim broja jedinki reaktanata i produkata utječu i agregacijska stanja tvari u reakciji.
Primjerice, ako u reakciji dva mola vodika s jednim molom kisika nastanu dva mola vodene pare, oslobodi se toplina od 483,6 kJ.
Ako u reakciji dva mola vodika s jednim molom kisika nastanu dva mola vode, oslobodi se toplina od 571,6 kJ.
Količina topline koja se oslobodila u reakciji u kojoj je produkt vodena para je manja za količinu topline koja se utrošila na isparavanje 2 mola vode u vodenu paru.
Standardna entalpija stvaranja
Standardna entalpija stvaranja predstavlja količinu topline koja se oslobađa ili troši nastankom 1 mola spoja nastalog iz kemijskih elemenata u njihovim standardnim stanjima pri tlaku od 100 kPa.
Standardna entalpija stvaranja označava se s (indeks f znači dolazi od engl. formation = stvaranje). Mjerna jedinica je .
Standardna entalpija stvaranja za svaki kemijski element u njegovu standardnom stanju, prema dogovoru, ima vrijednost 0.
Standardno stanje tvari je najstabilniji oblik čiste tvari pri tlaku od
100 kPa. Primjerice, grafit i dijamant su alotropske modifikacije ugljika. Grafit kao stabilnija modifikacija ima standardnu entalpiju , a dijamant .
Standardna entalpija stvaranja (ΔfH°) odnosi se na nastajanje 1 mola spoja iz kemijskih elemenata u njihovim standardnim stanjima pri tlaku (p) od 100 kPa.
Na primjeru kemijske jednadžbe stvaranja 1 mola glukoze iz elementarnih tvari:
6C (s) + 6H2 (g) + 3O2 (g) ⟶ C6H12O6 (s)
ΔfH° (C6H12O6, s) = −1268 kJ mol−1
zaključujemo da je standardna entalpija stvaranja glukoze ΔfH° (C6H12O6, s) = −1268 kJ mol−1.
Standardna entalpija stvaranja odnosi se na nastajanje jednoga mola spoja iz kemijskih elemenata u njihovim standardnim stanjima pri tlaku od 100 kPa.
Primjerice, tako standardnu entalpiju stvaranja jednoga mola glukoze iz elementarnih tvari prikazuje jednadžba kemijske reakcije:
Prema tome, može se zaključiti da je standardna entalpija stvaranja glukoze:
Riješeni primjer 1.
Izračunajte vrijednost standardne entalpije stvaranja (ΔfH°) aluminijeva oksida, , iz podataka za reakcijsku entalpiju napisane jednadžbe kemijske reakcije.
Izradak:
Standardna entalpija stvaranja (ΔfH°) odnosi se na nastajanje 1 mola spoja iz kemijskih elemenata u njihovim standardnim stanjima pri tlaku (p) od 100 kPa.
Zbog toga je reakciju potrebno napisati u suprotnom smjeru sa negativnom vrijednosti (–) za reakcijsku entalpiju (ΔfH°).
Za nastajanje 1 mola aluminijeva oksida (Al2O3) jednadžbu kemijske reakcije kao i vrijednost reakcijske entalpije potrebno je podijeliti s dva (: 2).
Odgovor:
Standardna entalpija stvaranja (ΔfH°) aluminijeva oksida je: .
Riješeni primjer 1.
Izračunajte vrijednost standardne entalpije stvaranja aluminijeva oksida, , iz podataka za reakcijsku entalpiju napisane jednadžbe kemijske reakcije.
Izradak:
Standardna entalpija stvaranja odnosi se na nastajanje 1 mola spoja iz kemijskih elemenata u njihovim standardnim stanjima pri tlaku od 100 kPa. Zbog toga reakciju treba napisati u suprotnom smjeru pri čemu se mijenja predznak reakcijske entalpije. Za nastajanje 1 mola aluminijeva oksida jednadžbu kemijske reakcije kao i vrijednost reakcijske entalpije potrebno je podijeliti s dva.
Odgovor:
Standardna entalpija stvaranja aluminijeva oksida je: .
Energijske promjene tijekom kemijske reakcije mogu se prikazati i entalpijskim dijagramima.
Energijske promjene tijekom kemijske reakcije mogu se prikazati i entalpijskim dijagramima.
Entalpijski dijagrami
U egzotermnim reakcijama je: jer se toplina oslobađa.
U endotermnim reakcijama je: jer se toplina troši.
Izračunavanje standardne reakcijske entalpije
Standardna reakcijska entalpija može se odrediti:
a) eksperimentalno
b) izračunati iz standardnih entalpija stvaranja (ΔfH°) spojeva u reakciji.
Prirast reakcijske entalpije (ΔrH°) jednak (=) je razlici (–) ukupne entalpije produkata (HP°) i ukupne entalpije reaktanata (HR°).
∆rH° = H°produkti– H°reaktanti
∆rH° = HP° – HR°
U egzotermnim reakcijama je:
U endotermnim reakcijama je: jer se toplina troši.
Izračunavanje standardne reakcijske entalpije
Standardna reakcijska entalpija se može odrediti eksperimentalno, ali i izračunati iz standardnih entalpija stvaranja spojeva u reakciji.
Prirast reakcijske entalpije, , jednak je razlici ukupne entalpije produkata, , i ukupne entalpije reaktanata, .
Riješeni primjer 2.
Izračunajte vrijednost standardne reakcijske entalpije (ΔrH°) za reakciju gorenja metana (CH4).
Jednadžba kemijske reakcije:
Zadano je:
Prirast standardne reakcijske entalpije ( ) izračuna se tako da se od ukupne vrijednosti svih entalpija nastajanja produkata (ΔfH°) oduzmu (–) standardne entalpije nastajanja reaktanata (ΔfH°).
Odgovor:
Vrijednost standardne reakcijske entalpije (ΔrH°) za navedenu reakciju gorenja metana (CH4) je .
Riješeni primjer 2.
Izračunajte vrijednost standardne reakcijske entalpije za reakciju gorenja metana.
Jednadžba kemijske reakcije:
Zadano je:
Prirast standardne reakcijske entalpije ( ) izračuna se tako da se od ukupne vrijednosti svih entalpija nastajanja produkata oduzmu standardne entalpije nastajanja reaktanata.
Odgovor: Vrijednost standardne reakcijske entalpije za navedenu reakciju gorenja metana je .
Standardna entalpija izgaranja označava se s ∆cH°.
Indeks c znači engl. combustion = izgaranje.
Standardna entalpija izgaranja (∆cH°) jednaka (=) je oslobođenoj toplini (Q) koja nastaje izgaranjem 1 mola (n) tvari.
Mjerna jedinica standardne entalpije izgaranja je kJ mol–1 (čitamo: kilodžul po molu–1).
Standardna entalpija izgaranja označava se s , (indeks c dolazi od engl. combustion = izgaranje) jednaka je oslobođenoj toplini koja nastaje izgaranjem 1 mola tvari. Mjerna jedinica je ista kao za svaku entalpiju, .
Riješeni primjer 3.
Standardna reakcijska entalpija (ΔrH°) za reakciju gorenja metana (CH4) iznosi .
Izračunajte koliko se topline (Q) oslobodi gorenjem 5 mola (n) metana (CH4).
Zadano je:
n(CH4) = 5,00 mol
Traži se:
Q = ?
Izradak:
Jednadžba kemijske reakcije:
Toplina (Q) oslobođena gorenjem 5,00 mola (n) metana (CH4) jednaka (=) je umnošku (·) reakcijske entalpije (ΔrH°) i omjera množine (n) metana (CH4) i njegovog stehiometrijskog koeficijenta u reakciji.
Napomena: Budući da se jednadžba kemijske reakcije odnosi na gorenje jednog mola metana (CH4), stehiometrijski koeficijent metana je jednak (=) broju jedan (1).
Odgovor:
Gorenjem 5 mola (n) metana (CH4) oslobodi se toplina (Q) od 4450 kJ.
Riješeni primjer 3.
Standardna reakcijska entalpija za reakciju gorenja metana iznosi . Izračunajte koliko se topline oslobodi gorenjem 5,00 mola metana.
Zadano je:
n(CH4) = 5,00 mol
Traži se:
Q = ?
Izradak:
Jednadžba kemijske reakcije:
Toplina oslobođena gorenjem 5,00 mola metana jednaka je umnošku reakcijske entalpije i omjera množine metana i njegovog stehiometrijskog koeficijenta u reakciji.
Napomena: Budući da se jednadžba kemijske reakcije odnosi na gorenje jednog mola metana, stehiometrijski koeficijent metana je jednak broju jedan.
Odgovor: Gorenjem 5,00 mola metana oslobodi se toplina od 4451 kJ.
Hessov zakon
Hessov zakon poznat je i kao zakon o očuvanju energije.
Prema Hessovu zakonu reakcijska entalpija (ΔrH°) jednaka (=) je zbroju (+) prirasta reakcijskih entalpija svih koraka na koje se može podijeliti reakcija.
Ova aditivnost (zbrojivost) je direktna posljedica činjenice da je entalpija funkcija stanja.
To znači da ona ne ovisi o putu reakcije, nego samo o stanju u kojem se sustav nalazio na početku i na kraju reakcije.
Kod praktičnog izračunavanja neke reakcijske entalpije korisno je reakcijsku jednadžbu rastaviti na niz takvih koraka za koje su entalpije poznate.
Hessov zakon
Prema Hessovu zakonu, koji je poznat i kao zakon o očuvanju energije, reakcijska entalpija jednaka je zbroju prirasta reakcijskih entalpija svih koraka na koje se može podijeliti reakcija. Ova aditivnost je direktna posljedica činjenice da je entalpija funkcija stanja, tj. da ona ne ovisi o putu reakcije, nego samo o stanju u kojem se sustav nalazio na početku i na kraju reakcije.
Kod praktičnog izračunavanja neke reakcijske entalpije korisno je reakcijsku jednadžbu rastaviti na niz takvih koraka za koje su entalpije poznate.
Riješeni primjer 4.
Izračunajte standardnu reakcijsku entalpiju (ΔrH°)za reakciju sinteze propana (C3H8) na temelju napisanih reakcija opisanih jednadžbama kemijskih reakcija.
Korak 1.
Prvu jednadžbu kemijske reakcije potrebno je napisati u suprotnome smjeru jer je propan produkt u reakciji u kojoj se računa standardna entalpija stvaranja (ΔfH°) propana.
Promjenom smjera reakcije vrijednost standardne reakcijske entalpije dobiva pozitivan predznak.
Korak 2.
Budući da u konačnoj jednadžbi kemijske reakcije reagiraju 3 mola atoma ugljika (C2) sa 4 mola molekula vodika (H2) potrebno je:
- drugu jednadžbu kemijske reakcije pomnožiti s 3 (·3),
- treću jednadžbu kemijske reakcije pomnožiti s 2 (·2),
Korak 3
Odgovor:
Reakcijska entalpija (ΔrH°) za reakciju sinteze propana, , iznosi = – 103,8 kJ mol–1.
Budući da je reakcijom sinteze nastao 1 mol propana, , spajanjem elemenata, navedena vrijednost je i standardna entalpija stvaranja propana (ΔfH°).
Prema tome, = – 103,8 kJ mol–1.
Riješeni primjer 4.
Izračunajte standardnu reakcijsku entalpiju za reakciju sinteze propana na temelju napisanih reakcija opisanih jednadžbama kemijskih reakcija.
Korak 1.
Prvu jednadžbu kemijske reakcije potrebno je napisati u suprotnome smjeru jer je propan produkt u reakciji u kojoj se računa standardna entalpija stvaranja propana.
Promjenom smjera reakcije vrijednost standardne reakcijske entalpije dobiva pozitivan predznak.
Korak 2.
Budući da u konačnoj jednadžbi kemijske reakcije reagiraju 3 mola atoma ugljika sa 4 mola molekula vodika potrebno je drugu jednadžbu kemijske reakcije pomnožiti s 3, a treću s 2.
Korak 3
Odgovor:
Reakcijska entalpija za reakciju sinteze propana, , iznosi = – 103,8 kJ mol–1.
Budući da je reakcijom sinteze nastao 1 mol propana, , spajanjem elemenata, navedena vrijednost je i standardna entalpija stvaranja propana.
Prema tome, = – 103,8 kJ mol–1.
Entalpija veze
Mjera za jakost kovalentne veze između atoma u molekulama naziva se standardna entalpija veze (ΔbH°).
Indeks b znači engl. bond = veza.
Pri kidanju kovalentne kemijske veze između atoma vodika (H2) i atoma klora (Cl2) u njihovim molekulama potrebno je utrošiti određenu energiju.
H2(g) → 2H(g)
ΔbH°(H-H) = 436 kJ mol–1
Cl2(g) → 2Cl(g)
ΔbH°(Cl-Cl) = 243 kJ mol–1
Za kidanje jednog mola veza u molekulama vodika (H2) potrebno je dovesti 436 kJ.
Za kidanje jednog mola veza u molekulama klora (Cl2) potrebno je dovesti 243 kJ.
Što je veza između atoma jača, vrijednost entalpije veze (ΔbH°) je veća >.
Entalpija veze
Mjera za jakost kovalentne veze između atoma u molekulama naziva se standardna entalpija veze, , gdje indeks b znači engl. bond = veza.
Pri kidanju kovalentne kemijske veze između atoma vodika u molekulama vodika, kao i atoma klora u molekulama klora potrebno je utrošiti određenu energiju.
Prema tome, za kidanje jednog mola veza u molekulama vodika potrebno je dovesti 436 kJ, a za kidanje jednog mola veza u molekulama klora 243 kJ.
Što je veza između atoma jača, vrijednost entalpije veze je veća.
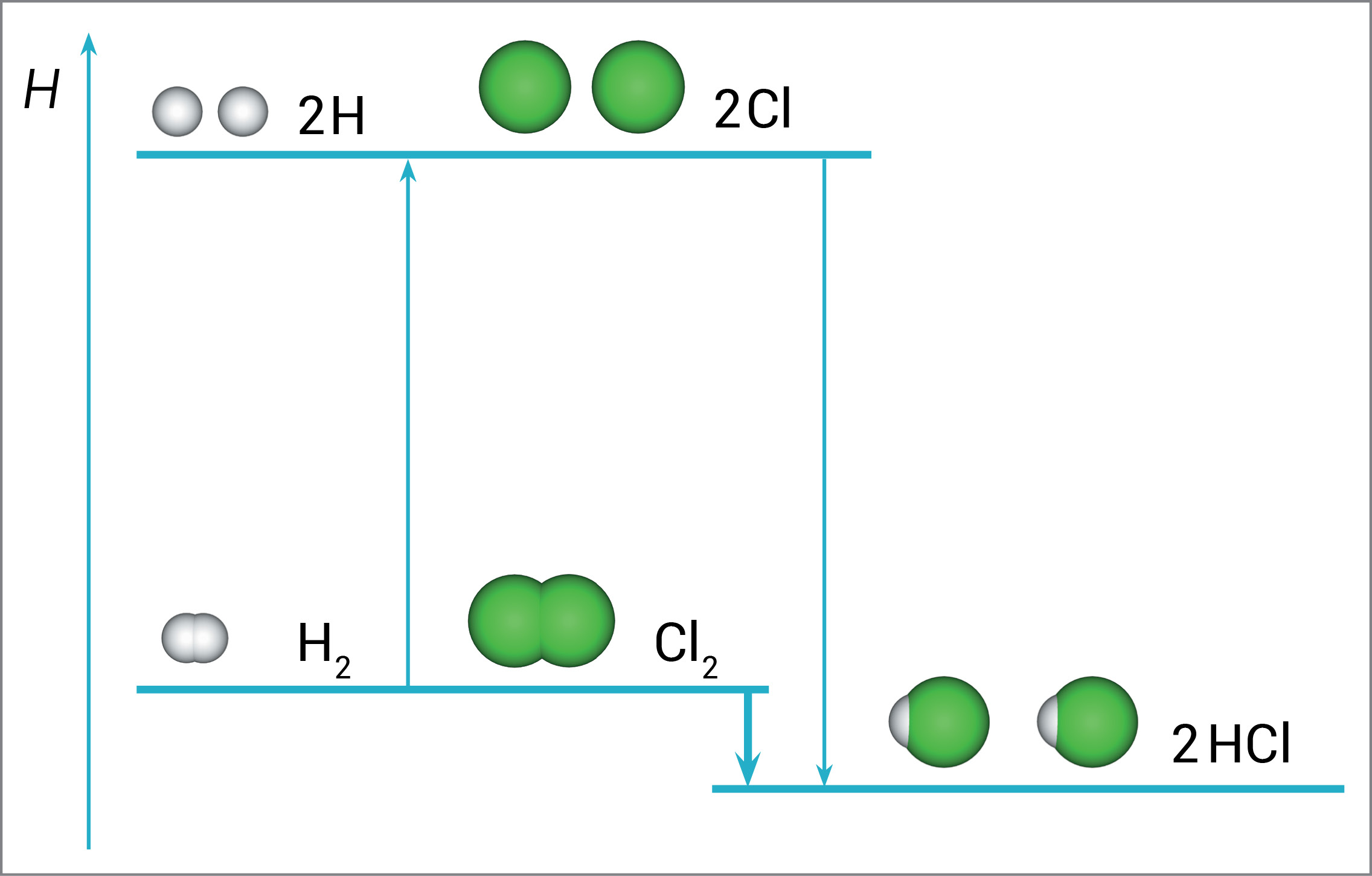
Riješeni primjer 5.
Pomoću standardnih entalpija veza, izračunajte standardnu entalpiju sinteze klorovodika.
Pozorno pogledajte videozapis.
Prirast standardne entalpije jednak je zbroju standardnih entalpija za kidanje i nastajanje veza.
Za kidanje veza uzimaju se pozitivne, a za nastajanje veza negativne vrijednosti standardnih entalpija veza.
Na kraju…
Razmislite i riješite sljedeće interaktivne zadatke!
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Standardna reakcijska entalpija za reakciju gorenja etanola je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Termičkim raspadom olovova(II) nitrata nastaju olovov(II) oksid, dušikov(IV) oksid i kisik.
Standardna reakcijska entalpija za navedenu reakciju iznosi:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?




