Elektrokemijski izvori električne energije
- uočiti važnost elektrokemije u svakodnevnom životu
- opisati princip rada gorivnog članka kao suvremenog izvora električne energije
Uvod
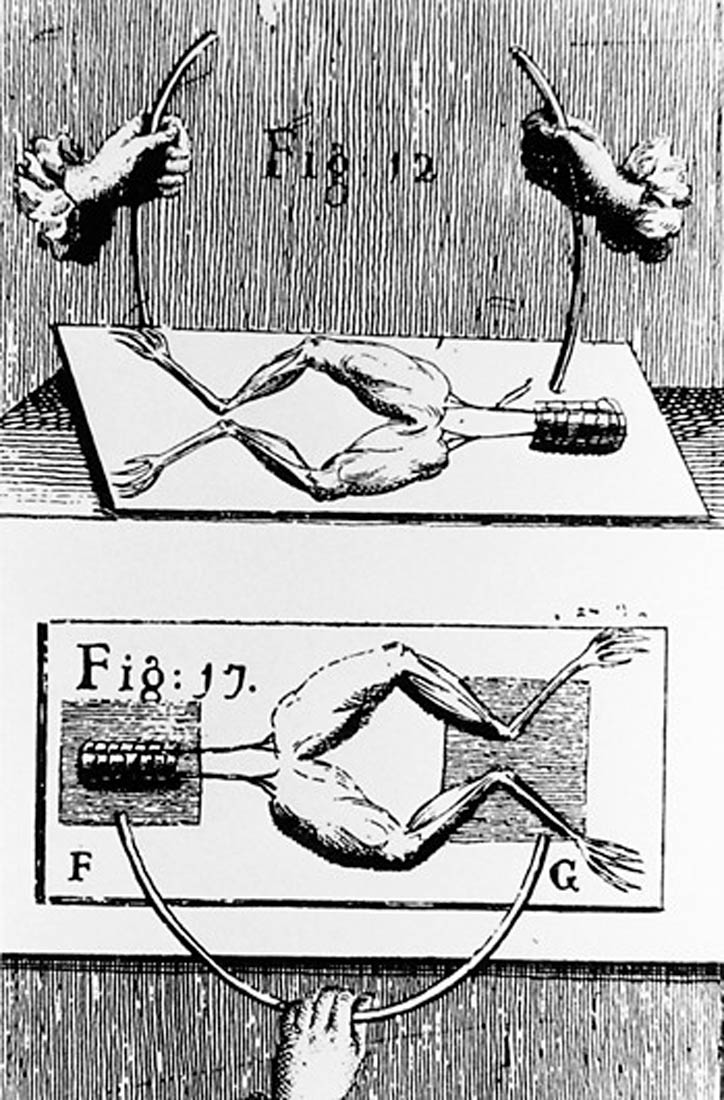
Luigi Galvani i Alessandro Volta postavili su temelje proizvodnje i primjene istosmjerne električne struje, krajem 18. stoljeća.
Luigi Galvani bio je profesor anatomije na Sveučilištu u Bologni.
Alessandro Volta bio je profesor fizike na Sveučilištu u Comu.
Uvod
Luigi Galvani, profesor anatomije na Sveučilištu u Bologni i Alessandro Volta, profesor fizike na Sveučilištu u Comu krajem 18. stoljeća postavili su temelje proizvodnje i primjene istosmjerne električne struje.
Galvanski članci
Elektrokemijske izvore električne energije može se podijeliti na:
- primarne galvanske članke
- sekundarne galvanske članke
Primarni galvanski članci su baterije koje nisu punjive.
Zbog toga se mogu smatrati neobnovljivim izvorima električne struje.
Kemijska energija nepovratno se pretvara u električnu energiju.
Sekundarni galvanski članci su punjive baterije i akumulatori.
Zbog toga se mogu smatrati obnovljivim izvorima električne struje.
Kemijske reakcije u sekundarnim galvanskim člancima su reverzibilne.
Primarni galvanski članci
Najpoznatiji primarni galvanski članak je i danas Leclanchéov članak (čitaj Lklanšeov članak).
Izumio ga je 1866. godine francuski elektroinženjer Georges Leclanché (1839. – 1882.) (čitati Žorž Lklanše).
Leclanchéov članak je građen od cinkove posudice.
Cinkova poudica koja je negativna (-) elektroda (anoda), zaštićena metalnim plaštom.
Atomi cinka (Zn) iz cinkove posudice oksidacijom prelaze u cinkove ione.
Zbog toga stjenke posudice postaju sve tanje.
Pozitivna (+) elektroda (katoda) je grafitni štapić uronjen u smjesu manganova (IV) oksida () i čađe (C).
Članak se naziva suhi članak jer je elektrolit gusta vlažna higroskopna smjesa amonijeva klorida (), cinkova klorida () i želatine ili škroba koji služi za geliranje.
Pojednostavljeno, na elektrodama pri radu članka dolazi do ovih reakcija:
Anoda:
Katoda:
Ukupnu kemijsku reakciju baterije uključene u strujni krug prikazuje jednadžba:
Napon Leclanchéovog (čitaj Lklanšeovog) članka iznosi 1,5 V.
Veći (>) napon može se postići serijskim povezivanjem članaka.
Galvanski članci
Elektrokemijske izvore električne energije može se podijeliti na primarne i sekundarne galvanske članke.
Primarni galvanski članci su baterije koje nisu punjive zbog čega se mogu smatrati neobnovljivim izvorima električne struje. Kemijska se energija u primarnim galvanskim člancima nepovratno pretvara u električnu, kemijske reakcije su ireverzibilne.
Sekundarni galvanski članci su punjive baterije i akumulatori zbog čega se mogu smatrati obnovljivim izvorima električne struje. Kemijske reakcije u sekundarnim galvanskim člancima su reverzibilne.
Primarni galvanski članci
Najpoznatiji primarni galvanski članak je i danas Leclanchéov članak. Izumio ga je 1866 Georges Leclanché (1839 – 1882) (čitati Žorž Lklanše) francuski elektroinženjer.
Leclanchéov članak je građen od cinkove posudice koja je negativna elektroda (anoda) zaštićena metalnim plaštom. Atomi cinka iz cinkove posudice oksidacijom prelaze u cinkove ione, zbog čega stijenke posudice postaju sve tanje. Pozitivna elektroda (katoda) je grafitni štapić uronjen u smjesu manganova(IV) oksida, i čađe, C.
Članak se naziva suhi članak jer je elektrolit gusta vlažna higroskopna smjesa amonijeva klorida, , cinkova klorida, i želatine ili škroba koji služi za geliranje.
Pojednostavljeno, na elektrodama pri radu članka dolazi do ovih reakcija:
Anoda:
Katoda:
Ukupnu kemijsku reakciju baterije uključene u strujni krug prikazuje jednadžba:
Napon Leclanchéovog članka iznosi 1,5 V. Veći napon može se postići serijskim povezivanjem članaka.
Današnje baterije imaju niz prednosi u odnosu na prvi Leclanchéov članak.
One imaju veći (>) napon.
Trajnije su i mogu se koristiti pri nižim (<) temperaturama.
Današnje baterije imaju niz prednosi u odnosu na prvi Leclanchéov članak. One imaju veći napon, trajnije su i mogu se koristiti pri nižim temperaturama.
Sekundarni galvanski članci
Sekundarni galvanski članci su akumulatori.
Akumulatori su reverzibilni galvanski članci koji se nakon pražnjenja mogu ponovo puniti.
Pri punjenju akumulatora električna energija se pretvara u kemijsku energiju.
Pri pražnjenju akumulatora kemijska energija se pretvara u električnu energiju.
kemijska energija električna energija
1. Olovni akumulator
U olovnom akumulatoru negativni (–) pol, anoda, je elektroda od olova (Pb).
Pozitivan (+) pol, katoda, je elektroda od olovova (IV) oksida (PbO2).
Elektrolit je 20 %-tna sumporna kiselina (H2SO4).
Sekundarni galvanski članci
Sekundarni galvanski članci su akumulatori, reverzibilni galvanski članci koji se nakon pražnjenja mogu ponovo puniti. Pri punjenju akumulatora električna se energija pretvara u kemijsku, a pri pražnjenju kemijska u električnu.
kemijska energija električna energija
1. Olovni akumulator
U olovnom akumulatoru negativni pol, anoda, je elektroda od olova, a pozitivan pol, katoda, je elektroda od olovova(IV) oksida.
Elektrolit je 20 %-tna sumporna kiselina.
Svaki članak olovnog akumulatora ima napon od 2 volta.
Olovni akumulator koji se koristi u osobnim automobilima ima napon 12 volti.
Prema tome, serijski je spojeno 6 članaka.
Reakcija punjenja i pražnjenja akumulatora može se prikazati jednadžbom kemijske reakcije:
2. Nikal-kadmijev akumulator
U nikal-kadmijevom akumulatoru negativni (-) pol, anoda, je elektroda od kadmija (Cd).
Pozitivan (+) pol, katoda, je elektroda od niklova (III) hidroksida (Cd(OH)2).
Elektrolit je kalijeva lužina (KOH) koja ne sudjeluje u reakciji.
Reakcija punjenja i pražnjenja akumulatora može se prikazati jednadžbom kemijske reakcije:
Napon jednog članka nikal-kadmijeva akumulatora je 1,25 V.
Gorivni članak
Gorivni članci su vrsta galvanskih članaka.
U njima se kemijskom reakcijom primjerice vodika (H2) i kisika (O2) neposredno dobiva električna energija.
Svaki članak olovnog akumulatora ima napon od 2 volta. Olovni akumulator koji se koristi u osobnim automobilima ima napon 12 volta, prema tome serijski je spojeno 6 članaka.
Reakcija punjenja i pražnjenja akumulatora može se prikazati jednadžbom kemijske reakcije:
2. Nikal-kadmijev akumulator
U nikal-kadmijevom akumulatoru negativni pol, anoda, je elektroda od kadmija, a pozitivan pol katoda, je elektroda od niklova(III) hidroksida. Elektrolit je kalijeva lužina koja ne sudjeluje u reakciji.
Reakcija punjenja i pražnjenja akumulatora može se prikazati jednadžbom kemijske reakcije:
Napon jednog članka nikal-kadmijeva akumulatora je .
Gorivni članak
Do sada je praktično primijenjen samo gorivni članak vodik – kisik.
U gorivnom članku vodik – kisik električna energija nastaje reakcijom sinteze vodika () i kisika ( ) u vodu.
Do sada je praktično primijenjen samo gorivni članak vodik – kisik, u kojem električna energija nastaje reakcijom sinteze vodika i kisika u vodu.
U gorivnom članku su grafitne s katalizatorom (nikal, Ni ili paladij, Pd), porozne, kako bi mogle propuštati plinove ( i ) koji reagiraju s elektrolitom.
Elektrolit je kalijeva lužina (KOH) koji u vodenoj otopini disocira na kalijeve (K+) i hidroksidne (OH–) ione.
Reakcije u gorivnom članku:
anoda (–): oksidacija
katoda (+): redukcija
Opisana redoks reakcija uzrokuje tok elektrona u vanjskom strujnom krugu.
Gorivni članci ekološki su prihvatljivi izvori električne energije.
U gorivnom članku elektrode su grafitne s katalizatorom (nikal ili paladij), porozne, kako bi mogle propuštati plinove ( i ) koji reagiraju s elektrolitom.
Elektrolit je kalijeva lužina koja u vodenoj otopini disocira na kalijeve i hidroksidne ione.
Reakcije u gorivnom članku:
anoda (–):
katoda (+):
Opisana redoks-reakcija uzrokuje tok elektrona u vanjskom strujnom krugu. Gorivni članci ekološki su prihvatljivi izvori električne energije.
Na kraju…
Riješite kviz!
Unesite odgovore na pripadajuća mjesta.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Tvari sadržane u starim baterijama i akumulatorima vrlo su opasne i štetne za okoliš.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Stoga, tvari sadržane u starim baterijama i akumulatorima treba odvajati od ‘običnog’, ‘kućnog’ otpada i odlagati u posebne spremnike.
Posebni spremnici se nalaze u reciklažnim dvorištima ili spremnicima predviđenim za tu vrstu opasnog otpada.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Danas se rabe olovni akumulatori kod kojih su i anoda i katoda izgrađene od
olovova (IV) oksida (PbO2).
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Galvanski članci koji sadrže kadmij (Cd) moraju se nakon uporabe pravilno zbrinuti jer je kadmij (Cd) teški metal.
Odložen nekontrolirano u prirodi može zagaditi podzemne vode.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Neke se baterije isplati reciklirati.
Zašto odbaciti vrijednu sirovinu ako je možemo ponovno upotrijebiti?
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Tvari sadržane u starim baterijama i akumulatorima vrlo su opasne i štetne za okoliš.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Baterije treba odvajati od ‘običnog’, ‘kućnog’ smeća i odlagati u posebne spremnike u reciklažnim dvorištima ili spremnicima predviđenim za tu vrstu opasnog otpada.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Anoda i katoda u olovnom akumulatoru izgrađene su od olovova(IV) oksida.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Galvanski članci koji sadrže kadmij moraju se nakon uporabe pravilno zbrinuti jer je kadmij teški metal i odložen nekontrolirano u prirodi može zagaditi podzemne vode.
Je li tvrdnja točna ili netočna? Odaberite klikom na gumb.
Je li ova tvrdnja točna?
Neke se baterije isplati reciklirati. Zašto odbaciti vrijednu sirovinu ako je možemo ponovno upotrijebiti?
Želite li pokušati ponovo?