Brzina kemijske reakcije
- objasniti pojam brzine kemijske reakcije
- na temelju računa odrediti doseg reakcije
- povezati doseg reakcije s množinom reakcijskih pretvorbi
- izračunati brzinu kemijske reakcije, brzinu trošenja reaktanta i brzinu nastajanja produkta
- grafički prikazati rezultate mjerenja brzine kemijske reakcije
Uvod
Brzina je sastavni dio života.
Brzina se definira kao fizikalna veličina kojom se opisuje gibanje.
Brzinom se pokazuje koliki je put prešlo (neko) tijelo u jedinici vremena.
Vrijednost prosječne brzine prikazana je omjerom:
gdje je:
Δs put koji je tijelo prešlo u vremenskom intervalu Δt.
Brzina se označava malim slovom v, koje je početno slovo latinske riječi za brzinu, velocitas.
Mjerna jedinica za brzinu u SI sustavu je metar u sekundi (m/s).
I kemijske reakcije odvijaju se različitim brzinama.
Brzina se definira kao fizikalna veličina kojom se opisuje gibanje, pokazuje koliki je put prešlo tijelo u jedinici vremena. Vrijednost prosječne brzine prikazana je omjerom:
gdje je Δs put koji je tijelo prešlo u vremenskom intervalu Δt.
Brzina se označava malim slovom v, koji je početno slovo latinske riječi za brzinu, velocitas. Mjerna jedinica za brzinu u SI sustavu je metar u sekundi (m/s).
Više informacija o brzini možete pronaći u jedinici 1.3 Brzina u DOS-u Fizika 1.
I kemijske reakcije odvijaju se različitim brzinama. Proučite sljedeće primjere kemijskih reakcija. Što možete zaključiti o brzinama njihova odvijanja?
Navedene reakcije nisu napredovale jednakom (=) brzinom (v).
Reakcija korozije je primjer vrlo spore reakcije.
Reakcija natrija () i klora () je primjer brze i burne reakcije.
Zaključite kojom se brzinom (v) odvija reakcija cinka () s klorovodičnom kiselinom () u odnosu na koroziju i reakciju natrija () i klora ()?
Navedene reakcije nisu napredovale jednakom brzinom. Reakcija korozije je primjer vrlo spore reakcije, dok je reakcija natrija i klora primjer brze i burne reakcije.
Na poznatom vam primjeru reakcije cinka s klorovodičnom kiselinom, zaključite kojom se brzinom odvija ta reakcija u odnosu na koroziju i reakciju natrija i klora?
Kemijska kinetika (prema grč. ϰıνητıϰός: koji se giba, koji pokreće) bavi se proučavanjem brzine kemijske reakcije.
Kemijska kinetika proučava i čimbenike koji utječu na brzinu kemijske reakcije.
Brzina kemijske reakcije
Brzina kemijske reakcije opisuje napredovanje kemijske reakcije s vremenom.
Kemijska reakcija napreduje:
a) dok svi reaktanti ne izreagiraju do kraja
b) dok mjerodavni reaktant izreagira do kraja, a reaktant u suvišku samo djelomično
c) do uspostavljanja kemijske ravnoteže
Kemijska kinetika (prema grč. ϰıνητıϰός: koji se giba, koji pokreće) bavi se proučavanjem brzine kemijske reakcije kao i čimbenicima koji utječu na brzinu kemijske reakcije.
Brzina kemijske reakcije
Brzina kemijske reakcije opisuje napredovanje kemijske reakcije s vremenom. Kemijska reakcija napreduje:
- dok svi reaktanti ne izreagiraju do kraja
- dok mjerodavni reaktant izreagira do kraja, a reaktant u suvišku samo djelomično
- do uspostavljanja kemijske ravnoteže.
U kemijskim reakcijama dolazi do pretvorbe reaktanata u produkte.
Koliko će nastati produkata i reagirati reaktanata možemo izraziti fizičkom veličinom koju nazivamo doseg reakcije.
Doseg reakcije označavamo grčkim slovom ksi, (ξ).
Doseg reakcije (ξ) pokazuje množinu jediničnih pretvorbi.
Množina jediničnih pretvorbi računa se tako da se množina (n) nekog od sudionika reakcije podijeli (:) sa stehiometrijskim koeficijentom (ν) tog istog sudionika.
Na sličan način moguće je izračunati doseg reakcije za svakog sudionika promatrane reakcije.
Brzina kemijske reakcije (v) opisuje napredovanje kemijske reakcije s vremenom.
Izražava se pomoću omjera dosega reakcije i vremena tijekom kojega je reakcija tekla.
Napredovanje reakcije (Δ ξ) definirano je izrazom:
Objasnimo napredovanje reakcije na primjeru raspada vodikova peroksida (H2O2).
Jednadžba kemijske reakcije:
Navedena jednadžba kemijske reakcije prikazuje kemijsku pretvorbu dviju molekula vodikova peroksida (H2O2) u dvije molekule vode (H2O) i jednu molekulu kisika (O2).
Budući da je broj takvih jediničnih pretvorbi jako velik, prati se promjena množine jednog od reaktanata ili produkata.
Zbog toga što se koncentracija (c) reaktanata tijekom reakcije smanjuje, stehiometrijski koeficijenti (ν) reaktanata su negativni (–).
Koncentracija (c) produkata raste i njihovi stehiometrijski koeficijenti (ν) su pozitivni (+).
Prema tome stehiometrijski koeficijenti (ν) u navedenoj reakciji su:
U kemijskim reakcijama dolazi do pretvorbe reaktanata u produkte. Koliko će nastati produkata i reagirati reaktanata možemo izraziti fizičkom veličinom koju nazivamo doseg reakcije i označiti ga grčkim slovom ksi, (ξ).
Doseg reakcije pokazuje množinu jediničnih pretvorbi koju se računa tako da se množina nekog od sudionika reakcije podijeli sa stehiometrijskim koeficijentom tog istog sudionika. Na sličan način moguće je izračunati doseg reakcije za svakog sudionika promatrane reakcije.
gdje je:
Δn – promjena množine jedne od tvari koja sudjeluje u reakciji
– stehiometrijski koeficijent te iste tvari (jednog od reaktanta ili produkata).
Objasnimo napredovanje reakcije na primjeru raspada vodikova peroksida.
Navedena jednadžba kemijske reakcije prikazuje kemijsku pretvorbu dviju molekula vodikova peroksida u dvije molekule vode i jednu molekulu kisika.
Budući da je broj takvih jediničnih pretvorbi jako velik, prati se promjena množine jednog od reaktanata ili produkata.
Zbog toga što se koncentracija reaktanata tijekom reakcije smanjuje, stehiometrijski koeficijenti reaktanata su negativni, dok koncentracija produkata raste i njihovi stehiometrijski koeficijenti su pozitivni.
Prema tome stehiometrijski koeficijenti u navedenoj reakciji su:
Riješeni primjer 1
Na početku reakcije množina vodikova peroksida () bila je 3,00 mola.
Nakon nekog vremena ostala je množina 0,500 mola ().
Za koliko je napredovala reakcija?
Zadano je:
Traži se:
Izradak:
Odgovor:
Rekcija je napredovala za 1,25 mola.
Riješeni primjer 1.
Ako uzmemo da je na početku reakcije množina vodikova peroksida bila 3,00 mola, a nakon nekog vremena ostala je množina 0,500 mola, za koliko je napredovala reakcija?
Zadano je:
Traži se:
Izradak:
Odgovor:Reakcija je napredovala za 1,25 mola.
Mjerna jedinica napretka reakcije (dosega reakcije), Δ ξ, jednaka (=) mjernoj jedinici za množinu tvari (n).
Mjerna jedinica napretka reakcije (dosega reakcije), Δ ξ, je mol.
Za istu reakciju doseg će biti isti, bez obzira računamo li preko reaktanata ili produkata.
Brzina reakcije (v) je omjer dosega reakcije (Δξ ) i vremena (Δt) tijekom kojega je reakcija tekla:
.
Zbog praktičnih razloga tu istu brzinu (v) moguće je izraziti na drugi način.
Naime, budući da je volumen (V) u mnogim reakcijama stalan, relaciju možemo proširiti s volumenom:
Koncentraciju tvari lakše možemo mjeriti nego li množinu tvari (n).
Stoga, izraz za brzinu reakcije možemo napisati pomoću koncentracije (c):
gdje je:
v – brzina kemijske reakcije
Δc – (promjena ) prirast množinske koncentracije
– stehiometrijski koeficijent
Δt – vremenski interval.
Mjerna jedinica za brzinu kemijske reakcije u SI sustavu je mol dm–3 s–1 (čtamo: mol po kubnom decimetru u sekundi)
Prosječna brzina kemijske reakcije
Prosječna brzina (v) kemijske reakcije ovisi o prirastu množinske koncentracije (∆c) reaktanata ili produkata u odabranom vremenskom intervalu (∆t).
Može se zaključiti da je mjerna jedinica napretka reakcije (dosega reakcije) jednaka mjernoj jedinici za množinu tvari, mol. Za istu reakciju doseg će biti isti, bez obzira računamo li preko reaktanata ili produkata.
Vratimo se sada na pojam ”brzina kemijske reakcije”. Brzina reakcije je omjer dosega reakcije i vremena tijekom kojega je reakcija tekla:
.
Zbog praktičnih razloga tu istu brzinu moguće je izraziti na drugi način. Naime, budući da je volumen u mnogim reakcijama stalan, relaciju možemo proširiti s volumenom:
Budući da koncentraciju tvari lakše možemo mjeriti nego li množinu tvari, izraz za brzinu reakcije možemo napisati pomoću koncentracije:
gdje je:
v – brzina kemijske reakcije
Δc – (promjena ) prirast množinske koncentracije
– stehiometrijski koeficijent
Δt – vremenski interval.
Mjerna jedinica za brzinu kemijske reakcije u SI sustavu je
mol dm–3 s–1.
Prosječna brzina kemijske reakcije
Prosječna brzina kemijske reakcije ovisi o prirastu množinske koncentracije reaktanata ili produkata u odabranom vremenskom intervalu.
Prosječna brzina kemijske reakcije
Općenito, za hipotetsku reakciju:
aA + bB → cC + dD
brzinu (v) možemo iskazati pomoću bilo kojeg od sudionika reakcije:
Za mjerenje brzine kemijske reakcije (v) može se odabrati bilo koji reaktant ili produkt.
Može se mjeriti promjena koncentracije (∆c) odabranog reaktanta ili produkta tijekom vremena (∆t).
Osim brzine kemijske reakcije razlikujemo brzinu trošenja reaktanata, v (R), i brzinu nastajanja produkata, v (P) :
Podijelimo (:) li brzinu trošenja reaktanata, v (R), ili brzinu nastajanja produkata produkata, v (P) s odgovarajućim sehiometrijskim koeficijentom (νr) tada se dobije vrijednost brzine kemijske reakcije.
Općenito, za hipotetsku reakciju:
brzinu možemo iskazati pomoću bilo kojeg od sudionika reakcije:
a) reaktanata (A i B):
b) produkata (C i D):
Osim brzine kemijske reakcije razlikujemo;
a) brzinu trošenja reaktanata:
b) brzinu nastajanja produkata:
Podijelimo li brzinu trošenja reaktanata ili brzinu nastajanja produkata s odgovarajućim stehiometrijskim koeficijentom tada se dobije vrijednost brzine kemijske reakcije.

Zakon brzine reakcije
Pojam zakona brzine formulirali su Guldberg i Waage tzv. zakonom o djelovanju masa.
Brzina reakcije (v) proporcionalna je koncentracijama reagirajućih tvari.
Prema tome za navedenu hipotetsku reakciju:
aA + bB → cC + dD
vrijedi:
k – konstanta brzine kemijske reakcije
Ta se jednadžba zove zakon brzine reakcije.
Brzina reakcije (v) jednaka (=) je umnošku (∙) konstante brzine reakcije i množinskih koncentracija (c) reaktanata potenciranih apsolutnim vrijednostima njihovih stehiometrijskih koeficijenata (ν).
Red reakcije
Osim zakona brzine reakcije Guldberg i Waage formulirali su i red reakcije.
O mehanizmu kinetike kemijskih reakcija, to jest o putu kojim se odvijaju, ne možemo zaključivati samo na osnovi jednadžbe kemijske reakcije.
Za takve spoznaje potrebno je eksperimentalnim putem ispitati odnos brzine (v) i koncentracije (c) reaktanata koje sudjeluju u kemijskoj reakciji, odnosno red reakcije.
Eksponent u zakonu brzine određuje red reakcije i utjecaj koncentracije (c) svakog reaktanta na brzinu (v) reakcije.
Kemijske reakcije mogu se podijeliti prema redu reakcije.

Zakon brzine reakcije
Pojam zakona brzine formulirali su Guldberg i Waage tzv. zakonom o djelovanju masa.
Brzina reakcije proporcionalna je koncentracijama reagirajućih tvari.
Prema tome za navedenu hipotetsku reakciju:
vrijedi:
k – konstanta brzine kemijske reakcije
Ta se jednadžba zove zakon brzine reakcije.
Brzina reakcije jednaka je umnošku konstante brzine reakcije i množinskih koncentracija reaktanata potenciranih apsolutnim vrijednostima njihovih stehiometrijskih koeficijenata.
Red reakcije
Osim zakona brzine reakcije Guldberg i Waage formulirali su i red reakcije. O mehanizmu kinetike kemijskih reakcija, to jest o putu kojim se odvijaju, ne možemo zaključivati samo na osnovi jednadžbe kemijske reakcije.
Za takve spoznaje potrebno je eksperimentalnim putem ispitati odnos brzine i koncentracije reaktanata koje sudjeluju u kemijskoj reakciji, odnosno red reakcije. Eksponent u zakonu brzine određuje red reakcije i utjecaj koncentracije svakog reaktanta na brzinu reakcije. Kemijske reakcije mogu se podijeliti prema redu reakcije.
Zadatak 1.
Za reakciju: A → produkti, dobiveni su sljedeći podatci:
| c(A)/mol L-1 | v/ mol L-1 s-1 |
|---|---|
| 0,10 | 0,15 |
| 0,20 | 0,30 |
| 0,40 | 0,60 |
Odgovorite na pitanja:
a) Kako se mijenja početna brzina reakcije (v) ako se koncentracija (c) reaktanta A udvostruči (∙ 2)?
b) Napišite matematički izraz (zakon brzine) koji pokazuje funkcionalnu ovisnost početne brzine reakcije (v) i koncentracije (c) reaktanta A.
c) Kako se naziva reakcija čija brzina (v) slijedi uočenu zakonitost?
Odgovori:
a) Podatci iz tablice pokazuju da će se i početna brzina (v) udvostručiti (·2).
b)
c) Reakcija je prvog reda.
Zadatak 1
Za neku reakciju u kojoj se reaktant A razlaže na produkte, dobiveni su sljedeći podatci:
| c(A)/mol L-1 | v/ mol L-1 s-1 |
|---|---|
| 0,10 | 0,15 |
| 0,20 | 0,30 |
| 0,40 | 0,60 |
Odgovorite na pitanja:
a) Kako se mijenja početna brzina reakcije ako se koncentracija reaktanta A udvostruči?
b) Napišite matematički izraz (zakon brzine) koji pokazuje funkcionalnu ovisnost početne brzine reakcije i koncentracije reaktanta A.
c) Kako se naziva reakcija čija brzina slijedi uočenu zakonitost?
Odgovori:
a) Podatci iz tablice pokazuju da će se i početna brzina udvostručiti.
b)
c) Reakcija je prvog reda.
Zadatak 2
Za reakciju ispitivan je utjecaj koncentracija (c) reaktanata na početnu brzinu (v) pri stalnoj temperaturi. Dobiveni su sljedeći podatci:
| pokus | c(A)/mol L-1 | c(B)/mol L-1 | v /mol L-1 s-1 |
|---|---|---|---|
| 1 | 0,10 | 0,010 | 1,2 x 10-5 |
| 2 | 0,10 | 0,040 | 4,8 x 10-5 |
| 3 | 0,20 | 0,010 | 2,4 x 10-5 |
a) Kako na brzinu (v) reakcije utječe povećanje koncentracije (c) reaktanta A?
b) Kako na brzinu reakcije (v) utječe povećanje koncentracije (c) reaktanta B?
c) Kojeg je reda ta reakcija?
d) Izračunajte koeficijent brzine reakcije.
Odgovori:
a) Ako se koncentracija (c) reaktanta A udvostruči (·2) i brzina (v) reakcije se udvostruči (·2).
b) Ako se koncentracija (c) reaktanta B poveća četiri puta (·4) i brzina (v) reakcije se poveća četiri puta (·4) .
c) Reakcija drugog reda
d)
Zadatak 2
Za reakciju ispitivan je utjecaj koncentracija reaktanata na početnu brzinu pri stalnoj temperaturi. Dobiveni su sljedeći podatci:
| pokus | c(A)/mol L-1 | c(B)/mol L-1 | v /mol L-1 s-1 |
|---|---|---|---|
| 1 | 0,10 | 0,010 | 1,2 x 10-5 |
| 2 | 0,10 | 0,040 | 4,8 x 10-5 |
| 3 | 0,20 | 0,010 | 2,4 x 10-5 |
Odgovorite na pitanja:
a) Kako se mijenja brzina reakcije, ako se udvostruči koncentracija reaktanta A?
b) Kako se mijenja brzina reakcije, ako se četiri puta poveća koncentracija reaktanta B?
c) Kojeg je reda ta reakcija?
d) Izračunajte koeficijent brzine reakcije.
Odgovori:
a) Ako se koncentracija reaktanta A udvostruči i brzina reakcije se udvostruči.
b) Ako se koncentracija reaktanta B poveća četiri puta i brzina reakcije se poveća četiri puta.
c) Reakcija drugog reda
d)
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji od navedenih izraza prikazuje brzinu (v) nastajanja amonijaka (NH3).
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jednadžba kemijske reakcije prikazuje sintezu amonijaka (NH3).
Koji od navedenih izraza prikazuje brzinu (v) kemijske reakcije?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Brzina kemijske reakcije (v) iskazana je izrazima:
Odaberite ispravno napisanu jednadžbu kemijske reakcije.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji od navedenih izraza prikazuje brzinu nastajanja amonijaka.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jednadžba kemijske reakcije prikazuje sintezu amonijaka. Koji od navedenih izraza prikazuje brzinu kemijske reakcije?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Brzina kemijske reakcije iskazana je izrazima:
Odaberite ispravno napisanu jednadžbu kemijske reakcije.
Želite li pokušati ponovo?
Ako je brzina nastanka produkta C, v (C), za hipotetsku reakciju:
, tada je brzina reaktanta A, v (A), __________ , produkta B, v (B) ___________
Rezultate iskažite na dvije značajne znamenke.
Odgovor: + pojašnjenje
v (A) = 0,45 mol L–1 s–1
v (B) = 0,15 mol L–1 s–1
Brzina nastajanja produkta B jednaka (=) je brzini reakcije (v).
Brzina reakcije, v(reakcije), je dva puta (∙2) manja (<) od nastanka produkta C.
Brzina trošenja reaktanta A tri puta (∙3) je veća (>) od brzine reakcije, v(reakcije).
Ako je brzina nastanka produkta C za hipotetsku reakciju:
v(C) = 0,30 , tada je brzina trošenja reaktanta A __________ , produkta B ___________ .
Rezultate iskažite na dvije značajne znamenke.
Odgovor i pojašnjenje:
Brzina nastajanja produkta B jednaka je brzini reakcije, koja je dva puta manja od nastanka produkta C. Brzina trošenja reaktanta A tri puta je veća od brzine reakcije.
Riješeni primjer 2
Pri katalitičkoj oksidaciji amonijaka () uz katalizator kromov (III) oksid () nastaju dušik () i vodena para ().
Brzina nastajanja dušika () iznosi 0,71 mol L-1 s-1.
Kolika je brzina:
a) navedene reakcije, v (reakcije) ?
b) trošenja amonijaka, v () ?
c) trošenja kisika, v (O2)?
d) nastajanja vodene pare, v () ?
Rezultate iskažite na tri značajne znamenke.
a) Brzina navedene reakcije je, v (reakcije) = ?
Odgovor:
a) Brzina navedene reakcije je, v (reakcije) = 0,355 mol L–1 s–1
Uputa za rješavanje zadatka:
Zadana je brzina nastajanja dušika:
v (N2) = 0,71 mol L–1 s–1 .
Izračunajte brzinu kemijske reakcije, v (reakcije), budući da ona ima istu vrijednost bez obzira preko kojeg sudionika se računa:
b) Brzina trošenja amonijaka, v (NH3) = ?
Odgovor:
v (NH3) = 2 ⋅ 0,71 mol L–1 s–1
v (NH3) = 1,42 mol L–1 s–1.
Uputa za rješavanje zadatka:
Brzinu trošenja amonijaka, v (NH3), izračunati možete koristeći izračunatu brzinu reakcije, v (reakcije):
v (NH3) = v ⋅ ν(NH3)
ν (NH3) = 0,355 ⋅ 4 = 1,42 mol L–1 s–1
ν (NH3) = 1,42 mol L–1 s–1
Omjer brzina promjene amonijaka (NH3) i dušika () pokazuje da se amonijak troši dva puta (2 ∙) brže nego li što nastaje dušik:
c) Brzina trošenja kisika je, v (O2) = ?
Odgovor:
c)
Brzina trošenja kisika je v (O2) = 1,07 mol L–1 s–1
d) Brzina nastajanja vodene pare, v (H2O) = ?
Odgovor:
v (H2O) = 3 ⋅ v (N2)
v (H2O) = 3 ⋅ 0,71 mol L–1 s–1
v (H2O) = 2,13 mol L–1 s–1
Brzina nastajanja vodene pare je v (H2O, g) = 2,13 mol L–1 s–1
Riješeni primjer 2
Pri katalitičkoj oksidaciji amonijaka uz katalizator kromov(III) oksid, nastaju dušik i vodena para.
Brzina nastajanja dušika iznosi 0,710 mol L-1 s-1.
Kolika je brzina:
a) navedene reakcije
b) trošenja amonijaka
c) trošenja kisika
d) nastajanja vodene pare?
(Rezultate iskažite na tri značajne znamenke.)
a) Brzina navedene reakcije je:
Odgovor: Brzina navedene reakcije je:
Uputa za rješavanje zadatka:
Zadana je brzina nastajanja dušika:
Izračunajte brzinu kemijske reakcije budući da ona ima istu vrijednost bez obzira preko kojeg sudionika se računa:
b) Brzina trošenja amonijaka,
Odgovor:
Uputa za rješavanje zadatka:
Brzinu trošenja amonijaka izračunati možete koristeći izračunatu brzinu reakcije:
Omjer brzina promjene amonijaka i dušika pokazuje da se amonijak troši dva puta brže nego li što nastaje dušik:
c) Brzina trošenja kisika je,
Uputa za rješavanje zadatka:
Brzina trošenja kisika je
d) Brzina nastajanja vodene pare,
Uputa za rješavanje zadatka:
Brzina nastajanja vodene pare je
Brzina kemijske reakcije (v), brzina trošenja reaktanata i brzina nastajanja produkata uvijek su pozitivne (+) veličine.
Brzina kemijske reakcije, brzina trošenja reaktanata i brzina nastajanja produkata uvijek su pozitivne veličine.
Riješeni primjer
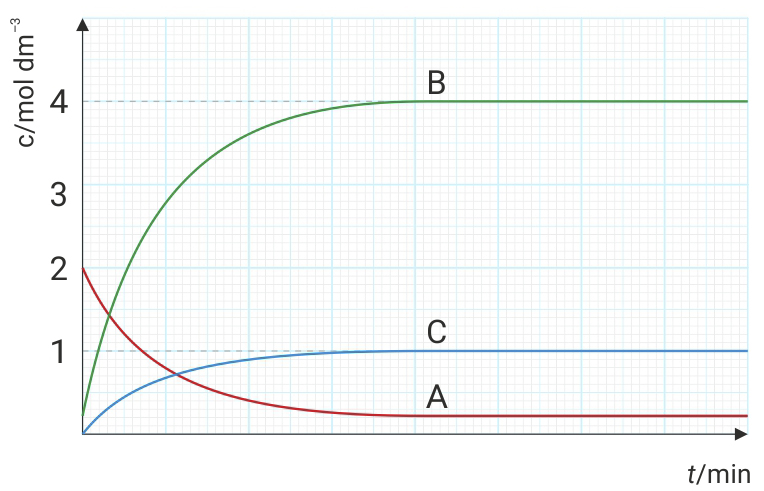
Zadan je dijagram za reakciju u kojoj sudjeluju plinovi A, B i C.
Koja od navedenih jednadžbi najbolje odgovara zadanoj reakciji?
A
B
C
D
Točan odgovor je pod C:
Koncentracija tvari A se smanjuje (troši).
Koncentracija tvari B i C se povećava.
Tvar A u reakciji je reaktant.
Tvari B i C su produkti.
Koncentracija (c) reaktanta A na početku reakcije je b.
Iznosi 2 mol dm–3.
Iz grafa očitavamo stehiometrijski koeficijent (v).
Vidljivo je da je tijekom reakcije reaktant A potpuno izreagirao.
Prema tome njegov stehiometrijski koeficijent (ν) u reakciji je 2.
Koncentracije (c) produkata B i C na početku reakcije su nula (o).
Iz grafa je vidljivo da stehiometrijski koeficijent (ν) produkta B iznosi 4, a produkta C iznosi 1.
Riješeni primjer 3
Zadan je dijagram za reakciju u kojoj sudjeluju plinovi A, B i C. Koja od navedenih jednadžbi najbolje odgovara zadanoj reakciji?
A)
B)
C)
D)
Točan odgovor je pod C.
Pojašnjenje:
Budući se koncentracija tvari A smanjuje (troši), a tvari B i C povećava, tvar A u reakciji je reaktant, a B i C su produkti. Koncentracija reaktanta A na početku reakcije je najveća i iznosi 2 mol dm–3.
Iz grafa očitavamo stehiometrijski koeficijent. Vidljivo je da je tijekom reakcije reaktant A potpuno izreagirao, prema tome njegov stehiometrijski koeficijent u reakciji je 2.
Koncentracije produkata B i C na početku reakcije su nula, a iz grafa je vidljivo da stehiometrijski koeficijent produkta B iznosi 4, a produkta C je 1.
Brzina reakcije, v (reakcije), nije stalna.
Ona se tijekom reakcije mijenja.
Reakcija je najbrža na početku kada su i koncentracije reaktanata najveće.
Reakcija postaje sve sporija kako se s vremenom koncentracije reaktanata smanjuju.
Zbog toga u nekoj reakciji razlikujemo brzinu reakcije kao:
1. početnu
2. trenutnu
3. prosječnu
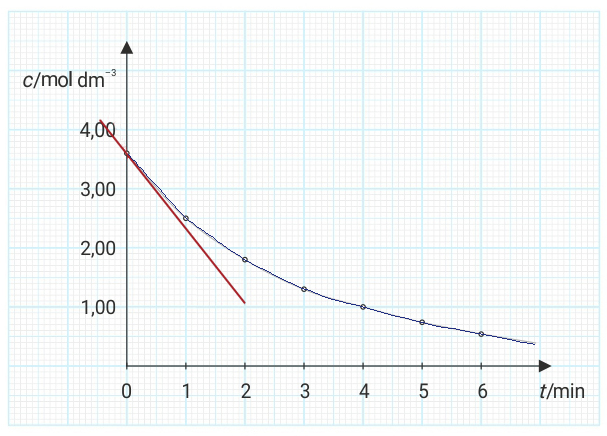
Početna brzina kemijske reakcije je brzina na samom početku reakcije dok je .
Brzina reakcije nije stalna, ona se tijekom reakcije mijenja. Reakcija je najbrža na početku kada su i koncentracije reaktanata najveće.
Kako se s vremenom koncentracije reaktanata smanjuju, tako reakcija postaje i sve sporija. Zbog toga u nekoj reakciji razlikujemo brzinu reakcije kao:
- početnu
- trenutnu
- prosječnu
Početna brzina kemijske reakcije je brzina na samom početku reakcije dok je .
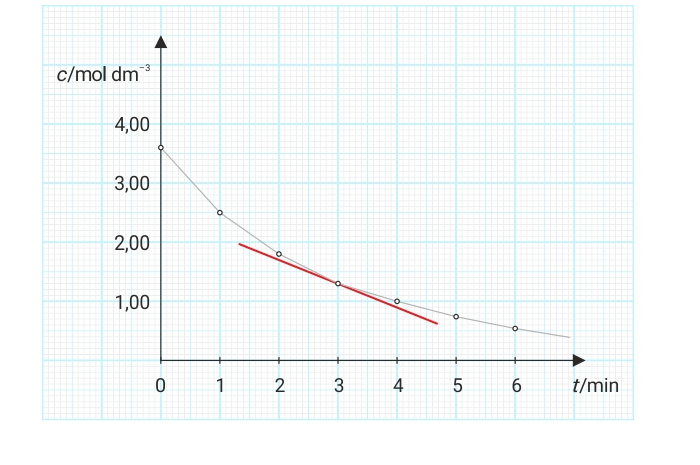
Trenutna brzina kemijske reakcije je brzina u nekom određenom trenutku.
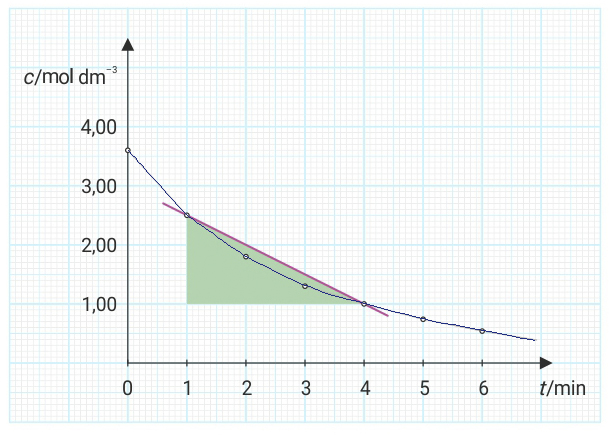
Smanjenjem vremenskog intervala na vrlo malu vrijednost može se odrediti trenutna brzina koju pokazuje nagib tangente na točku krivulje.
Trenutna brzina izračuna se iz koeficijenta smjera tangente.
Trenutna brzina kemijske reakcije je brzina u nekom određenom trenutku. Sa smanjenjem vremenskog intervala na vrlo malu vrijednost može se odrediti trenutna brzina koju pokazuje nagib tangente na točku krivulje. Trenutna brzina izračuna se iz koeficijenta smjera tangente.
Na kraju…
Za neku općenitu reakciju: vrijedi:
| Brzina trošenja reaktanta
Brzina nastajanja produkta
|
Brzina reakcije
|
| Brzina trošenja reaktanata i brzina nastajanja produkata ne ovisi o stehiometrijskim koeficijentima. | Brzina reakcije ovisi o stehiometrijskim koeficijentima. |
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Mjerna jedinica za brzinu kemijske reakcije, v (reakcije), je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Pretpostavimo da se kemijska reakcija zbiva točno prema navedenoj jednadžbi kemijske reakcije:
2 A + B → 2 C + 3 D.
Koji je izraz za brzinu kemijske reakcije, v (reakcije), ispravno napisan?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
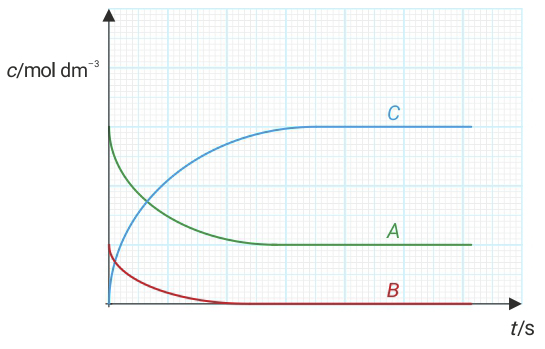
U reakciji sudjeluju tvari A, B i C.
Ovisnost koncentracije tih tvari o vremenu (t) prikazana je na grafičkom prikazu.
Koji je omjer tvari u reakciji ispravno napisan?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Vodikov peroksid (H2O2) se razlaže na kisik (O2) i vodu (H2O) prema jednadžbi:
Odaberite grafički prikaz označen slovima od A do D koji prikazuje promjene koncentracije tijekom navedene reakcije.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U posudi volumena (V) 250 mL pri temperaturi (T) 300 °C na početku reakcije bilo je 0,109 g .
Nakon 30 sekundi (Δt) 0,089 g.
Jednadžba kemijske reakcije:
Prosječna brzina reakcije s obzirom na iznosi:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Mjerna jedinica za brzinu kemijske reakcije je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Pretpostavimo da se kemijska reakcija zbiva točno prema navedenoj jednadžbi kemijske reakcije:
.
Koji je izraz za brzinu kemijske reakcije ispravno napisan?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
 U reakciji sudjeluju tvari A, B i C. Ovisnost koncentracije tih tvari o vremenu prikazana je na grafičkom prikazu. Koji je omjer tvari u reakciji ispravno napisan?
U reakciji sudjeluju tvari A, B i C. Ovisnost koncentracije tih tvari o vremenu prikazana je na grafičkom prikazu. Koji je omjer tvari u reakciji ispravno napisan?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Vodikov peroksid se razlaže na kisik i vodu prema jednadžbi:
Odaberite grafički prikaz koji prikazuje promjene koncentracije sudionika reakcije.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U posudi volumena 250 mL pri temperaturi 300 °C na početku reakcije bilo je 0,109 g , a nakon 30 sekundi 0,089 g.
Jednadžba kemijske reakcije:
Prosječna brzina reakcije s obzirom na iznosi:
Želite li pokušati ponovo?