Čimbenici koji utječu na brzinu kemijske reakcije
- nakon izvedenih pokusa objasniti kako agregacijsko stanje, ukupna površina reaktanata, koncentracija i temperatura utječu na brzinu kemijske reakcije
- objasniti i razlikovati pojmove: kataliza, katalizator i inhibitor
- nakon izvedenih pokusa objasniti kako temperatura i katalizator utječu na brzinu kemijske reakcije
- objasniti pojam enzima i ulogu enzimskih funkcija u živim sustavima
- primijeniti numeričke podatke očitane iz grafičkih prikaza
Uvod
Rješavajući interaktivni zadatak, pretpostavite u kojoj će od parova tikvica brzina biti veća (>).
Svoje odgovore usporedite s odgovorima drugih učenika u razredu.
Donesite zaključke o nekim čimbenicima koji utječu na brzinu kemijske reakcije.
Uvod
Rješavajući interaktivni zadatak, pretpostavite u kojoj će od parova tikvica brzina biti veća. Svoje odgovore usporedite s odgovorima drugih učenika u razredu i donesite zaključke o nekim čimbenicima koji utječu na brzinu kemijske reakcije.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jednadžba kemijske reakcije cinka (Zn) s razrijeđenom klorovodičnom kiselinom (HCl) je:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jednadžba kemijske reakcije cinka s razrijeđenom klorovodičnom kiselinom je:
Želite li pokušati ponovo?
Kako dolazi do kemijske reakcije?
Gibanjem se čestice sudaraju.
Svaki sudar čestica nije uspješan, tj. ne dovodi do produkta reakcije.
Da bi došlo do kemijske reakcije (uspješnog sudara) čestice moraju biti pravilno orijentirane, a njihova energija mora biti jednaka (=) ili veća (>) od energije aktivacije (Ea,).
Energija aktivacije, Ea, je minimalna količina kinetičke energije potrebne za nastajanje aktivacijskog kompleksa.
O čemu ovisi broj uspješnih sudara?
Na povećanje odnosno smanjenje broja uspješnih sudara u nekoj reakciji utječu sljedeći čimbenici:
- koncentracija
- temperatura
- površina reaktanata
- agregacijsko stanje.
Pozorno pogledajte animaciju.
Odgovorite na pitanja kako slijede.
Kako dolazi do kemijske reakcije?
Gibanjem se čestice sudaraju, ali svaki sudar čestica nije uspješan tj. ne dovodi do produkta reakcije.
Da bi došlo do kemijske reakcije tj. do uspješnog sudara čestice moraju biti pravilno orijentirane, a njihova energija mora biti jednaka ili veća od energije aktivacije.
Energija aktivacije, Ea je minimalna količina kinetičke energije potrebne za nastajanje aktivacijskog kompleksa.
O čemu ovisi broj uspješnih sudara?
Na povećanje odnosno smanjenje broja uspješnih sudara u nekoj reakciji utječu sljedeći čimbenici:
- koncentracija
- temperatura
- površina reaktanata
- agregacijsko stanje.
Pozorno pogledajte animaciju te potom odgovorite na pitanja kako slijede.
Unesite odgovore na pripadajuća mjesta.
Odgovor:
ΔbH° (H2,g) = 432 kJ/mol
ΔbH° (Cl2,g) = 240 kJ/mol
ΔbH° (HCl,g) = 428 kJ/mol
Ea = 432 kJ/mol + 240 kJ/mol
Ea = 672 kJ/mol
Unesite odgovore na pripadajuća mjesta.
Odgovor:
ΔrH° = (2 ⋅ – 428 kJ/mol ) – (– 672 kJ/mol)
ΔrH° = – 856 kJ/mol + 672 kJ/mol
ΔrH° = – 184 kJ/mol
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Utjecaj koncentracije i temperature na brzinu kemijske reakcije
Proučite upute za izvođenje pokusa, izvedite pokuse i zaključite kako promijene koncentracije i temperature utječu na brzinu kemijske reakcije.
Utjecaj koncentracije i temperature na brzinu kemijske reakcije
Proučite upute za izvođenje pokusa, izvedite pokuse i zaključite kako promijene koncentracije i temperature utječu na brzinu kemijske reakcije.
Rezultati pokusa pokazuju da brzina reakcije (v) ovisi o koncentraciji (c) reaktanata.
Što je koncentracija (c) reaktanata veća (>), broj mogućih uspješnih sudara je veći (>).
Prema tome, i reakcija je brža.
Brzina kemijske reakcije (v) raste s porastom temperature.
Općenito, ako se u nekoj reakcijskoj smjesi povisi temperatura za 10°C, brzina se približno udvostruči (·2)
Rezultati pokusa pokazuju da brzina reakcije ovisi o koncentraciji reaktanata. Što je koncentracija reaktanata veća, broj mogućih uspješnih sudara je veći, prema tome i reakcija je brža.
Brzina kemijske reakcije raste s porastom temperature. Općenito, ako se nekoj reakcijskoj smjesi povisi temperatura za 10 °C, brzina se približno udvostruči.
Značajnu primjenu u određivanju brzine (v) kemijskih reakcija kao i za izračunavanje energije aktivacije (Ea) ima Arrheniusova jednadžba.
Ona prikazuje ovisnost brzine reakcije o temperaturi.
Jednadžbu je predložio Svante Arrhenius 1889. godine.
Svante Arrhenius bio je švedski fizičar i kemičar.
1903. godine dobio Nobelovu nagradu za kemiju.
Značajnu primjenu u određivanju brzine kemijskih reakcija kao i za izračunavanje energije aktivacije ima Arrheniusova jednadžba.
Ona prikazuje ovisnost brzine reakcije o temperaturi. Jednadžbu je predložio Svante Arrhenius 1889. godine, švedski fizičar i kemičar koji je 1903. godine, dobio Nobelovu nagradu za kemiju.
Riješeni primjer 1.
U jednom molu (n) nekog plina izračunajte broj molekula (N) koje imaju energiju aktivacije (Ea) 47,0 kJ/mol pri temperaturi (t):
a) 10 °C
b) 20 °C
Zadano je:
Ea = 47,0 kJ mol–1
n (plin) = 1 mol
a) t = 10 °C
b) t = 20 °C
Traži se:
N (molekula plina s Ea) = ?
Postupak:
a) Broj molekula (N) koje imaju neku energiju aktivacije (Ea) može se izračunati prema izrazu:
b)
Odgovor:
Iz omjera broja aktiviranih molekula pri temperaturama 10 °C i 20 °C dobije se podatak da se s porastom temperature za samo 10 °C broj aktiviranih molekula povećao približno dva puta (·2).
Time se dva puta povećala (·2) i brzina reakcije (v).
Riješeni primjer 1.
U jednom molu nekog plina izračunajte broj molekula koje imaju energiju aktivacije 47,0 kJ/mol pri temperaturi: a) 10 °C i b) 20 °C.
Zadano je:
Ea = 47,0 kJ mol–1
n(plin) = 1,00 mol
a) t = 10 °C
b) t = 20 °C
Traži se:
N(molekula plina s Ea) = ?
Postupak:
a) Broj molekula koje imaju potrebnu energiju aktivacije pri 10 °C:
b) Broj molekula koje imaju potrebnu energiju aktivacije pri 20 °C:
Odgovor:
Iz omjera broja aktiviranih molekula pri temperaturama 10 °C i 20 °C dobije se podatak da se s porastom temperature za samo 10 °C broj aktiviranih molekula povećao približno dva puta, a time i brzina reakcije.
Zadatak za znatiželjne
Izračunajte broj molekula nekoga plina u jednom molu koje imaju
energiju aktivacije 39,0 kJ mol–1 pri temperaturi:
a) t = 20 °C
b) t = 40 °C
Odredite koliko puta i pri kojoj temperaturi ima više molekula koje imaju navedenu energiju aktivacije.
Odgovor:
a)
b)
Iz omjera broja aktiviranih molekula pri temperaturi 20 °C i 40 °C dobije se podatak da se s porastom temperature broj aktivniranih molekula povećao oko 2,77 puta, a time i brzina reakcije.
Riješeni primjer 2
Kako se mijenja brzina reakcije (v)
2NO (g) + O2 (g) → 2NO2 (g)
ako se volumen (V) reakcijske smjese poveća dva puta (∙2)?
Izradak:
Izraz za brzinu reakcije (v1):
Ako se volumen (V) reakcijske posude poveća dva puta (2∙), tlak se smanji dva puta (2∙).
Izraz za brzinu reakcije (v)
v2 = k ⋅ c(NO)2 /2 ⋅ c(O2) /2
v2 = k ⋅ c(NO)2 ⋅ c(O2) / 8
v2 = v1 / 8
Odgovor:
Ako se volumen (V) reakcijske posude poveća dva puta (∙2), brzina reakcije (v) se smanji osam puta (∙8)
Riješeni primjer 2
Kako se mijenja brzina reakcije , ako se volumen reakcijske smjese poveća dva puta?
Izradak:
Izraz za brzinu reakcije:
Ako se volumen reakcijske posude poveća dva puta, tlak se smanji dva puta.
Izraz za brzinu reakcije je:
Odgovor:
Ako se volumen reakcijske smjese poveća dva puta, brzina reakcije se smanji osam puta.
Kako površina reaktanata utječe na brzinu kemijske reakcije?
Kako površina reaktanata utječe na brzinu kemijske reakcije?
U čaše s razrijeđenom klorovodičnom kiselinom (HCl) ubaci se vapnenac u prahu i komadić vapnenca (CaCO3).
Zbog veće (>) površine vapnenca u prahu reakcija je brža u odnosu na onu reakciju u kojoj je u kiselinu bio ubačen komadić vapnenca.
Jednadžba kemijske reakcije vapnenca (CaCO3) i klorovodične kiseline (HCl):
U čaše s razrijeđenom klorovodičnom kiselinom ubaci se vapnenac u prahu i komadić vapnenca.
Zbog veće površine vapnenca u prahu reakcija je brža u odnosu na onu reakciju u kojoj je u kiselinu bio ubačen komadić vapnenca.
Jednadžba kemijske reakcije vapnenca i klorovodične kiseline:
Odgovorite na sljedeća pitanja:
1. Koja dva uvjeta moraju biti ispunjena da bi došlo do uspješnog sudara čestica reaktanata u reakciji?
2. Na koji način je povećan broj uspješnih sudara u reakciji vapnenca s klorovodičnom kiselinom? Obrazložite odgovor.
3. Je li jednaka brzina kemijske reakcije na početku i na kraju reakcije?
Odgovori:
1. Dva uvjeta koja moraju biti zadovoljena da bi došlo do uspješnog sudara čestica reaktanata u reakciji su: pravilna orijentacija čestica i energija aktivacije.
2. Usitnjavanjem vapnenca povećana je ukupna površina čestica, a time i broj uspješnih sudara i brzina reakcije.
3. Na početku reakcije je najveća koncentracija reaktanata i najveća brzina reakcije. Tijekom reakcije smanjuje se koncentracija reaktanata, a time i brzina reakcije.
Brzina reakcije (v) veća (>) je što je veća (>) ukupna površina reaktanata u čvrstom agregacijskom stanju.
Je li reakcija brža ako su reaktanti u čvrstom agregacijskom stranju ili ako su otopljeni u odgovarajućem otapalu?
Nakon što ste proučili upute za izvođenje pokusa, izvedite pokuse i zaključite kako agregacijsko stanje reaktanata utječe na brzinu kemijske reakcije.
Brzina reakcije veća je što je veća ukupna površina reaktanata u čvrstom agregacijskom stanju.
Je li reakcija brža ako su reaktanti u čvrstom agregacijskom stranju ili ako su otopljeni u odgovarajućem otapalu?
Nakon što ste proučili upute za izvođenje pokusa, izvedite pokuse i zaključite kako agregacijsko stanje reaktanata utječe na brzinu kemijske reakcije.
Iz svega što ste do sada naučili o brzini kemijske reakcije možete li pretpostaviti koja bi od navedenih reakcija bila brža?
1)
2)
Objasnite.
Odgovor:
Reakcija između iona brža je od reakcije između molekula, pa je ionska reakcija taloženja srebrova klorida brža, od molekulske reakcije esterifikacije.
Kako katalizator utječe na kemijsku reakciju?
Dodatkom
moguće je postići da se dovoljan broj uspješnih sudara postigne pri nižoj aktivacijskoj energiji u usporedbi s kemijskom reakcijom bez katalizatora.
Međutim, katalizator ne utječe na reaktante tako da poveća broj uspješnih sudara u onoj istoj reakciji koja teče bez katalizatora.
Katalizator promijeni kemijsku reakciju.
Činjenica da u obje reakcije, u onoj bez katalizatora i u onoj s katalizatorom, sudjeluju reaktanti iste vrste i produkti iste vrste navodi na pomisao da je riječ o istoj reakciji koju je katalizator samo ubrzao tako što je omogućio veći broj uspješnih sudara.
Međutim, s katalizatorom je aktivirana drugačija kemijska reakcija koja je energijski povoljnija.
Stoga, brže se odvija od reakcije bez katalizatora.
Dakle, može se reći da se uz katalizator brže dobiju produkti.
No, ne može se reći da je katalizator ubrzao onu kemijsku reakciju koja se sporo odvija.
U energijski povoljnijom reakciji katalizator može djelovati na različite načine.
On često kratkotrajno reagira s jednim od reaktanata tako da na kraju iz reakcije izlazi nepromijenjen.
Može svojom šupljikavošću povećati reakcijsku površinu i opet povećati broj uspješnih sudara.
Kako katalizator utječe na kemijsku reakciju?
Dodatkom
Međutim, katalizator ne utječe na reaktante tako da poveća broj uspješnih sudara u onoj istoj reakciji koja teče bez katalizatora, nego tako da promijeni kemijsku reakciju.
Činjenica da u obje reakcije, u onoj bez katalizatora i u onoj s katalizatorom, sudjeluju reaktanti iste vrste i produkti iste vrste navodi na pomisao da je riječ o istoj reakciji koju je katalizator samo ubrzao tako što je omogućio veći broj uspješnih sudara.
Međutim, s katalizatorom je aktivirana drugačija kemijska reakcija koja je energijski povoljnija, pa se brže odvija od reakcije bez katalizatora. Dakle, može se reći da se uz katalizator brže dobiju produkti, ali se ne može reći da je katalizator ubrzao onu kemijsku reakciju koja se sporo odvija.
U energijski povoljnijom reakciji katalizator može djelovati na različite načine. On često kratkotrajno reagira s jednim od reaktanata tako da na kraju iz reakcije izlazi nepromijenjen, a može svojom šupljikavošću povećati reakcijsku površinu i opet povećati broj uspješnih sudara.
Djelovanje katalizatora sastoji se u tome da on kratkotrajno reagira s jednim od reaktanata stvarajući nestabilni kompleks .
Nestabilni kompleks zatim prelazi u produkt AB i katalizator koji izlazi iz reakcije kemijski nepromijenje.
Tijekom reakcije katalizator može biti izložen promjenama, ali na kraju reakcije katalizator mora biti u jednakom stanju (=) kao na početku reakcije.
Ako je na kraju reakcije dodana tvar promijenjena, onda se takvu tvar ne može nazvati katalizatorom.
Katalizator je tvar koja ubrzava pridobivanje produkata jer pokreće kemijsku reakciju u kojoj je dovoljna manja (<) energija aktivacije .
Djelovanje katalizatora sastoji se u tome da on kratkotrajno reagira s jednim od reaktanata stvarajući nestabilni kompleks , koji zatim prelazi u produkt AB i katalizator koji izlazi iz reakcije kemijski nepromijenjen.
Dakle, tijekom reakcije katalizator može biti izložen promjenama, ali na kraju reakcije katalizator mora biti u jednakom stanju kao na početku reakcije. Ako je na kraju reakcije dodana tvar promijenjena, onda se takvu tvar ne može nazvati katalizatorom.
Katalizator je tvar koja ubrzava dobivanje produkata jer pokreće kemijsku reakciju u kojoj je dovoljna manja energija aktivacije .
Enzimi su biološki katalizatori.
Vodikov peroksid (H2O2) je jak stanični otrov.
Nastaje kao produkt metabolizma.
Može se razgraditi pomoću enzima katalaze koji se nalazi u jetri.
Jednadžba kemijske reakcije:
Enzimi su biološki katalizatori. Vodikov peroksid, jak stanični otrov, koji nastaje kao produkt metabolizma može se razgraditi pomoću enzima katalaze koji se nalazi u jetri.
Jednadžba kemijske reakcije:
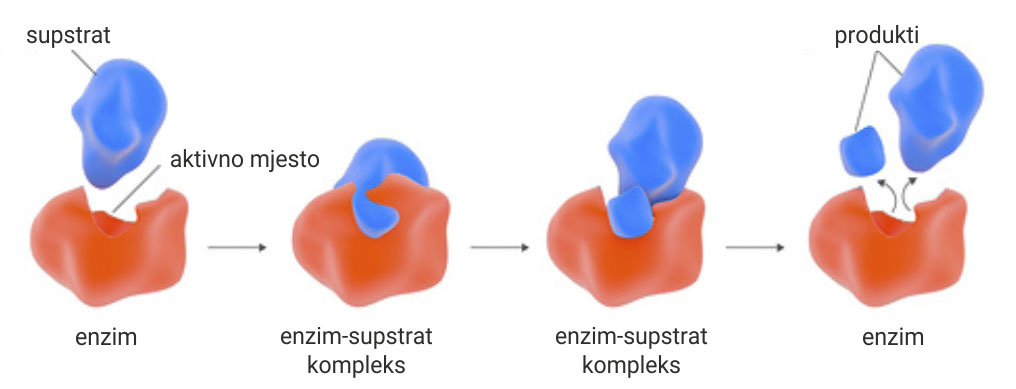
Svaka molekula enzima ima sposobnost vezanja supstrata.
Molekula supstrata (plava) veže se na aktivno mjesto molekule enzima (crveno).
Stvara se kompleks enzim-supstrat (središnji lijevi).
Nestabilni kompleks enzim – supstrat razlaže se na enzim i produkte reakcije.
Postoje li tvari koje smanjuju brzinu kemijske reakcije?
Katalizatori smanjuju energiju aktivacije (Ea).
Time povećavaju brzinu (v) kemijskih reakcija.
Postoje tvari koje povećavaju energiju aktivacije (Ea).
Time smanjuju brzinu (v) kemijske reakcije.
Takve tvari nazivaju se inhibitori.
Primjerice glicerin se koristi kao inhibitor razlaganja vodikovog peroksida (H2O2).
Na taj se način postiže stabilnost njegove otopine jer se smanjuje brzina razlaganja vodikova peroksida (H2O2) na vodik (H2) i kisik (O2).
Svaka molekula enzima ima sposobnost vezanja supstrata. Molekula supstrata (plava) veže se na aktivno mjesto molekule enzima (crveno), stvarajući kompleks enzim-supstrat (središnji lijevi). Nestabilni kompleks enzim – supstrat razlaže se na enzim i produkte reakcije.
Postoje li tvari koje smanjuju brzinu kemijske reakcije?
Ako katalizatori smanjuju energiju aktivacije i time povećavaju brzinu kemijskih reakcija, postoje tvari koje povećavaju energiju aktivacije i time smanjuju brzinu kemijske reakcije. Takve tvari nazivaju se
Primjerice, glicerin se koristi kao inhibitor razlaganja vodikova peroksida. Na taj se način postiže stabilnost njegove otopine jer se smanjuje brzina razlaganja vodikova peroksida na vodu i kisik.
Na kraju…
U alatu Mindomo (web 2.0 alat) izradite mentalnu mapu pomoću koje usustavite čimbenike koji utječju na brzinu kemijske reakcije.
Svoj uradak podijelite sa drugim učenicima u razredu, usporedite ih te međusobno vrednujte najuspješniji uradak.
Na kraju…
U alatu Mindomo (web 2.0 alat) izradite mentalnu mapu pomoću koje usustavite čimbenike koji utječju na brzinu kemijske reakcije. Svoj uradak podijelite sa drugim učenicima u razredu, usporedite ih te međusobno vrednujte najuspješniji uradak.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Brzina reakcije je:
Klikom odaberite jedan ili više točnih odgovora.
Odaberite sve točne odgovore.
Koji od navedenih dijagrama predstavljaju egzotermne promjene:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Jednadžba kemijske reakcije gorenja butanola je:
Brzina trošenja kisika u navedenoj reakciji je , a brzina nastajanja ugljikova(IV) oksida je:
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kako se mijenja brzina kemijske reakcije, , povećamo li koncentraciju komponente A dva puta?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Kako se međusobno odnose brzine za nekataliziranu i za kataliziranu reakciju,
, ako se pri uporabi katalizatora energija aktivacije smanji na polovicu početne vrijednosti?
Želite li pokušati ponovo?