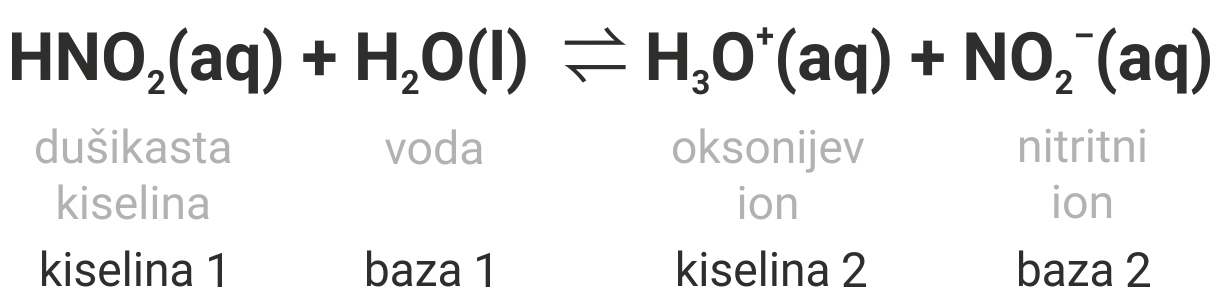Baze
- prikazati disocijaciju lužina
- definirati kiseline i baze prema Brønsted-Lowryjevoj teoriji
- razlikovati jake i slabe baze
Baze
Baze imaju veliku primjenu u kućanstvu.
Najčešće se nalaze u:
sredstvima za čišćenje i odmašćivanje pećnica, odvodnih cijevi i drugo.
Uvod
Baze ili lužine imaju veliku primjenu u kućanstvu, gdje se najčešće nalaze u sredstvima za čišćenje i odmašćivanje pećnica, odvodnih cijevi i drugo.
Svojstva baza
Lužine mijenjaju bezbojnu otopinu indikatora fenolftaleina u ljubičastu.
Lužine mijenjaju bezbojnu otopinu indikatora fenolftaleina u ljubičastu.
Je li vodena otopina pepela neutralna, kisela ili lužnata?
Odgovor na pitanje dobit ćete nakon što odgledate sljedeći videozapis.
Je li vodena otopina pepela neutralna, kisela ili lužnata? Odgovor na pitanje dobit ćete nakon što odgledate sljedeći videozapis.
Dobivanje kalcijeve lužine
Poznato je da su oksidi metala uglavnom bazičnog karaktera.
Primjerice:
kalcijev hidroksid (Ca(OH)2) može nastati reakcijom kalcijeva oksida (CaO) s vodom (H2O).
Jednadžbe kemijskih reakcija dobivanja kalcijeva hidroksida (Ca(OH)2) :
Dobivanje kalcijeve lužine
Općenito je poznato da su oksidi metala uglavnom bazičnog karaktera.
Jednadžbama kemijskih reakcija prikazano je dobivanje kalcijeva hidroksida iz kalcija:
Ako je hidroksid topljiv u vodi nastaje odgovarajuća lužina.
| ↓ | |
| kalcijeva lužina |
Lužine su vodene otopine hidroksida koji u reakciji s vodom povećavaju koncentraciju hidroksidnih, OH– iona.
Ako je hidroksid topljiv u vodi nastaje odgovarajuća lužina.
| ↓ | |
| kalcijeva lužina |
Prema tome, lužine su vodene otopine hidroksida koje u reakciji s vodom povećavaju koncentraciju hidroksidnih, , iona.
Alkalijski metali burno reagiraju s vodom.
Nastaju odgovarajuće lužine i vodik (H2).
Alkalijski metali burno reagiraju s vodom pri čemu također nastaju odgovarajuće lužine i vodik.
Baze se razlikuju po jakosti.
Jake baze su, primjerice:
- hidroksidi alkalijskih metala: cezijev hidroksid ( ), rubidijev hidroksid (), kalijev hidroksid ()
- hidroksidi zemnoalkalijskih metala: barijev hidroksid (), stroncijev hidroksid () i kalcijev hidroksid ().
Slabe baze su:
- amonijak,
- organske baze.
Mjera za jakost baza je:
- konstanta ionizacije, (engl. base – baza)
- stupanj ionizacije, α.
Jednadžba ionizacije neke hipotetske slabe baze
Konstanta ravnoteže, Kc, za reakciju ionizacije može se izraziti pomoću množinskih koncentracija (c):
Pomnožimo (∙) li obje strane s množinskim udjelom vode koji je praktično konstantan, na desnoj strani jednadžbe množinski udio vode će se pokratiti.
Dobit ćemo izraz za konstantu disocijacije baze, .
Stupanj ionizacije baza, omjer je broja ioniziranih molekula i ukupnog broja molekula.
Za slabe baze vrijedi:
Baze se razlikuju po jakosti. Jake su baze, primjerice, hidroksidi alkalijskih metala: , , i nekih zemnoalkalijskih metala: , i .
Slabe baze su amonijak, , i organske baze.
Mjera za jakost baza je njihova konstanta ionizacije (engl. base – baza) kao i stupanj ionizacije, .
Jednadžba ionizacije neke hipotetske slabe baze:
Konstanta ravnoteže za reakciju ionizacije može se izraziti pomoću množinskih koncentracija:
Pomnožimo li obje strane s množinskim udjelom vode koji je praktično konstantan, na desnoj strani jednadžbe množinski udio vode će se pokratiti pa ćemo dobiti izraz za konstantu ionizacije baze, .
Stupanj ionizacije baza, , omjer je broja ioniziranih molekula i ukupnog broja molekula.
Za slabe baze vrijedi:
Rješeni primjer 1.
Amonijeva lužina ( ) je slaba lužina.
U vodenoj otopini amonijaka (NH3) daleko je više (>) molekula amonijaka (NH3) od amonijevih (NH4+) i hidroksidnih iona (OH–).
Izračunajte množinsku koncentraciju (c) hidroksidnih iona (OH–) u vodenoj otopini amonijaka (NH3 (aq)).
Množinska koncentracija (c) amonijaka (NH3 (aq)) iznosi 0,25 mol/L.
Konstanta disocijacije (Kb) amonijeve lužine (NH3 (aq)) iznosi 1,8×10−5 mol dm−3 pri 25°C.
Zadano je:
c
Traži se:
c
1. korak
Amonijak (NH3) je plin vrlo neugodnog mirisa.
Dobro je topljiv u vodi:
Uvođenjem amonijaka (NH3) u vodu dolazi do ionizacije:
amonijeva lužina
2. korak
Izraz za konstantu disocijacije baze,
3. korak
Izračunaju se ravnotežne koncentracije i iona koristeći zadanu konstantu ionizacije baze Kb i sljedeću shemu
Izračunaju se ravnotežne koncentracije amonijevih i hidroksidnih iona koristeći zadanu konstantu ionizacije baze (Kb) i sljedeću shemu:
| početna koncentracija |
0,25 | 0 | 0 | |
|---|---|---|---|---|
| promjena | ||||
| ravnotežna koncentracija |
||||
Budući da su ravnotežne koncentracije amonijevih i hidroksidnih iona jednake, , označe se sa x.
Uvrste se u izraz za konstantu ionizacije baze, Kb:
Nakon vađenja drugog korijena dobije se:
To znači da je
Zbog vrlo malog broja molekula slabe baze može se pretpostaviti da je (0,25 mol dm−3 – x mol dm−3) približno jednako (≠) 0,25 mol dm−3.
Odgovor:
Koncentracija (c) molekula slabe baze je velika u odnosu na koncentraciju (c) ioniziranih molekula amnoijaka (NH3), x.
Može se pretpostaviti da je množinska koncentracija (c) hidroksidnih iona (OH–) je c (OH−) = 2,1×10−3 mol dm−3 ili 2,1 mmol dm−3.
Rješeni primjer 1.
Amonijeva lužina je slaba lužina. U vodenoj otopini amonijaka daleko je više molekula amonijaka od amonijevih i hidroksidnih iona.
Izračunajte množinsku koncentraciju hidroksidnih iona u vodenoj otopini amonijaka množinske koncentracije . Konstanta ionizacije amonijeve lužine je pri 25 °C.
Zadano je:
Traži se:
= ?
1. korak
Amonijak je plin vrlo neugodnog mirisa, dobro topljiv u vodi:
Uvođenjem amonijaka u vodu dolazi do ionizacije:
| ↓ | |
| amonijeva lužina |
2. korak
Izraz za konstantu ionizacije baze, ;
3. korak
Izračunaju se ravnotežne koncentracije i iona koristeći zadanu konstantu ionizacije baze, , i sljedeću shemu:
| početna koncentracija | 0,25 | 0 | 0 |
|---|---|---|---|
| promjena | |||
| ravnotežna koncentracija |
Zbog vrlo malog broja molekula slabe baze može se pretpostaviti da je približno jednako .
Iz jednadžbe reakcije ionizacije amonijaka u vodi, proizlazi da su ravnotežne koncentracije amonijevih i hidroksidnih iona jednake, . Navedene se koncentracije označe sa i uvrste u izraz za konstantu ionizacije baze, :
Nakon vađenja drugog korijena dobije se:
To znači da je:
Odgovor:
Množinska koncentracija hidroksidnih iona u vodenoj otopini amonijaka je; ili .
Budući da je koncentracija hidroksidnih iona znatno manja od koncentracije amonijaka, vodena otopina amonijaka je slaba lužina.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Točno napisana konstanta disocijacije (Kb) baze metilamina (CH3NH2) je:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Točno napisana konstanta ionizacije baze metilamina je:
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
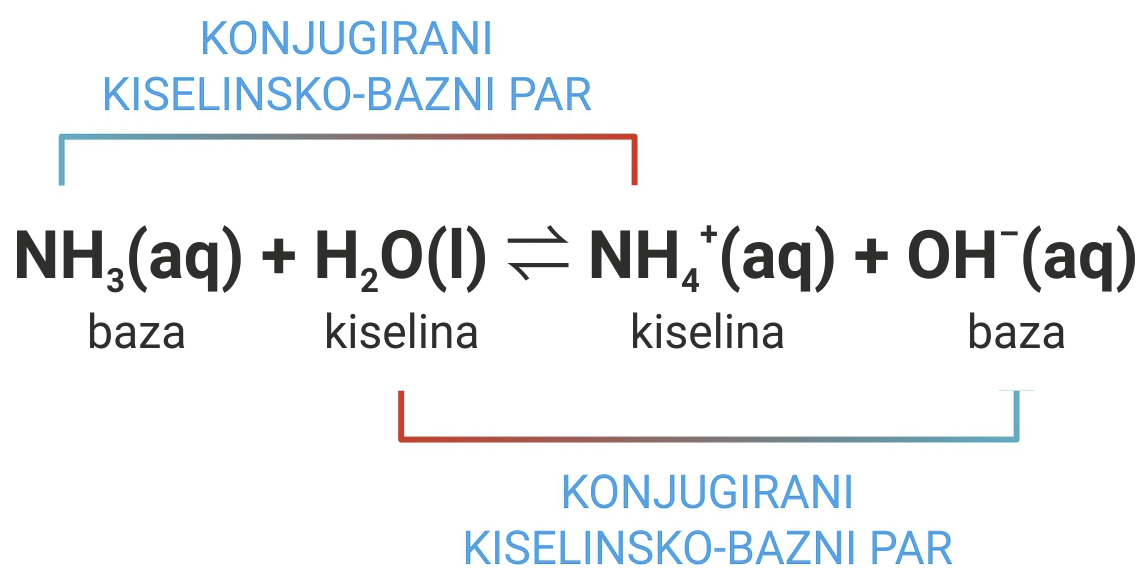
Konjugirani parovi kiselina–baza
Po Broensted – Lowry teoriji kiseline su tvari čije molekule daju protone – proton donori.
Baze tvari čije molekule primaju protone – proton akceptori.
Primjer 1.
Konjugirani parovi kiselina–baza
Po Brønsted-Lowryjevoj teoriji, kiseline su tvari čije molekule daju protone, proton donori, a baze tvari čije molekule primaju protone, proton akceptori.
Primjer 1.
Molekula dušikaste kiseline, HNO2, daje proton molekuli vode.
Stoga je proton donor i u reakciji djeluje kao kiselina.
Molekula vode prima proton.
Stoga je u reakciji proton akceptor, odnosno baza.
Navedena reakcija je ravnotežna reakcija.
Odvija se i u suprotnom smjeru (s desna na lijevo).
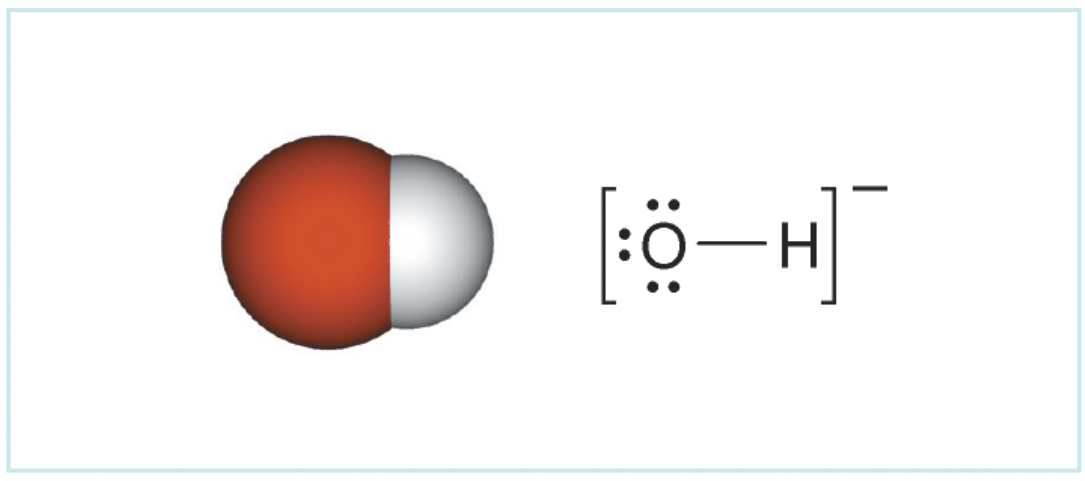
Oksonijev ion (H3O+(aq)) je kiselina (proton donor).
Nitritni ion (NO2–(aq)) je baza (proton akceptor).
Molekula dušikaste kiseline, , daje proton molekuli vode prema tome je proton donor i u reakciji djeluje kao kiselina.
Molekula vode prima proton pa je u reakciji proton akceptor odnosno baza.
Navedena reakcija je ravnotežna reakcija, koja se odvija i u suprotnom smjeru (s desna na lijevo).
Tada je oksonijev ion kiselina (proton donor), a nitritni ion je baza (proton akceptor).
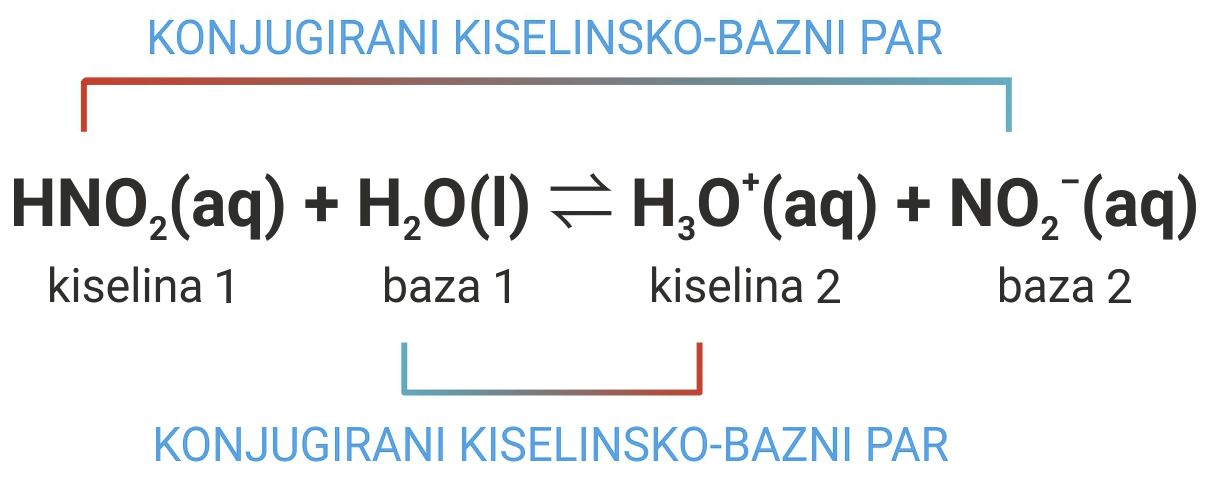
Molekula dušikaste kiseline (HNO2) ima jedan proton više (>) od nitritnog iona (NO2–).
Oksonijev ion (H3O+) ima jedan proton više (>) od molekule vode (H2O).
Takvi parovi jedinki HNO2 / NO2– i H3O+ / H2O nazivaju se konjugirani kiselinsko-bazni parovi.
Molekula dušikaste kiseline, , ima jedan proton više od nitritnog iona, , a oksonijev ion, , ima jedan proton više od molekule vode, .
Takvi parovi jedinki i nazivaju se konjugirani kiselinsko-bazni parovi.
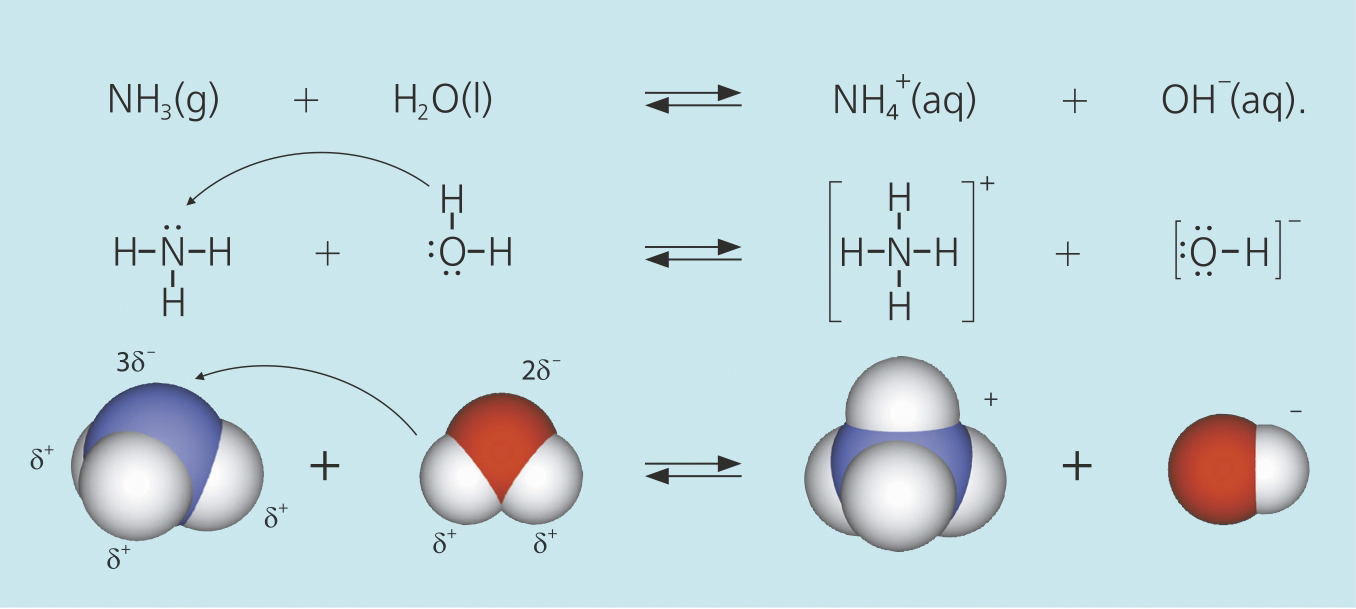
Primjer 2.
Konjugirani kiselinsko-bazni parovi u navedenom primjeru su H2O/ OH– i NH4+/NH3.
Konjugirani kiselinsko-bazni parovi u navedenom primjeru su i .
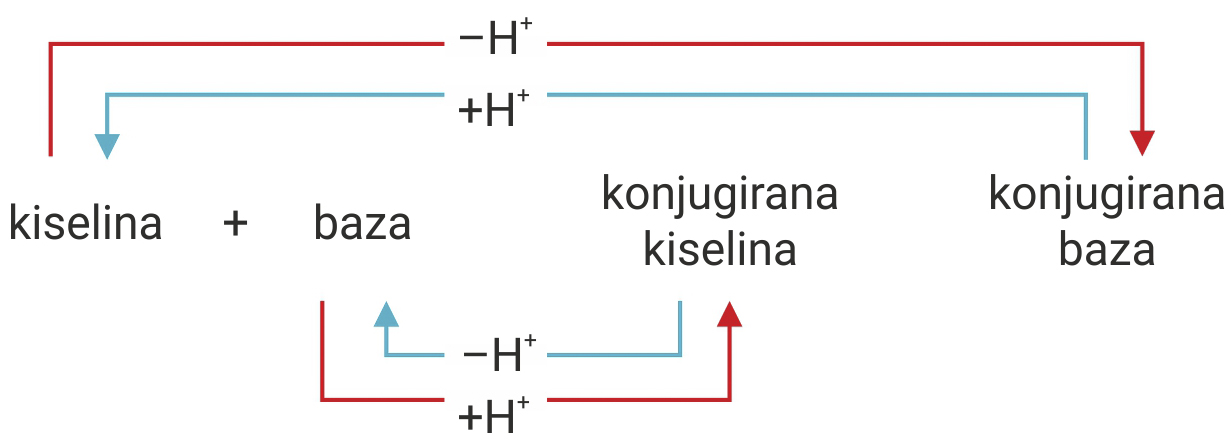
Što je kiselina jača, njezina konjugirana baza je slabija.
Što je kiselina slabija, njezina konjugirana baza je jača.
Što je kiselina jača, njezina konjugirana baza je slabija i obratno, što je kiselina slabija njezina konjugirana baza je jača.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U navedenoj jednadžbi kemijske reakcije konjugirana baza fluorovodične kiseline (HF) je:
Želite li pokušati ponovo?
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
U navedenoj jednadžbi kemijske reakcije konjugirana baza fluorovodične kiseline je:
Želite li pokušati ponovo?
| Slaba baza | |
|---|---|
| dimetilamin, | |
| metilamin, | |
| trimetilamin, | |
| amonijak, |
Na kraju…
Uz pomoć shematskog prikaza usustavite pojmove obrađene u ovoj jedinici DOS-a te potom riješite interaktivni kviz.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji od navedenih parova jedinki je konjugirani kiselinsko-bazni par?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Unesite odgovore na pripadajuća mjesta.
Klikom odaberite jedan točan odgovor.
Odaberite točan odgovor.
Koji od navedenih parova jedinki je konjugirani kiselinsko-bazni par?
Unesite odgovore na pripadajuća mjesta.
Želite li pokušati ponovo?